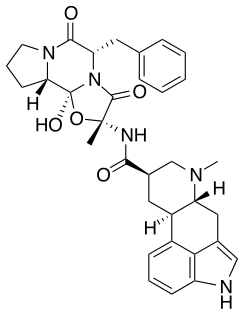
Dihydroergotamin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dihydroergotamin | |||||||||||||||||||||
| Andere Namen | (5S,10R)-5-Benzyl-12-hydroxy-2-methyl-9,10-dihydroergotaman-3,6,18-trion | |||||||||||||||||||||
| Summenformel | C33H37N5O5 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | N02CA01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 583,68 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | 6,8[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Dihydroergotamin (kurz DHE) ist ein vom Mutterkornalkaloid Ergotamin abgeleiteter Arzneistoff, der zur Therapie hypotoner Kreislaufstörungen eingesetzt wurde sowie zur Therapie der Migräne[3] und des Cluster-Kopfschmerzes[4] eingesetzt wird und der ärztlichen Verschreibungspflicht unterliegt. Der Wirkstoff wurde 1942 von Sandoz patentiert.[1] Verwendet werden das Mesilat[5] und das Tartrat[6] des Alkaloids.[1]
Wirkmechanismus
Dihydroergotamin ist ein Antagonist oder ein Partialagonist an verschiedenen Subtypen von α1-Adrenozeptoren, α2-Adrenozeptoren, Dopamin-Rezeptoren und Serotonin-Rezeptoren. Seine Migränewirksamkeit wird u. a. mit einem Partialagonismus an Serotonin-5-HT1B/1D-Rezeptoren erklärt.
Anwendung
Dihydroergotamin findet in der Therapie des akuten blutgefäßbedingten (Migräne-)Kopfschmerzes Anwendung, in einigen Ländern auch zur Behandlung von Demenzerkrankungen.[7] Nicht mehr zulässig ist Dihydroergotamin in der EU zur Prophylaxe von Migränekopfschmerz, zur Behandlung der orthostatischen Hypotonie und zur symptomatischen Behandlung bei venös-lymphatischer Insuffizienz. In einer Risikobewertung basierend auf aktuellen Erkenntnissen urteilte der Ausschuss für Humanarzneimittel (Committee for Medicinal Products for Human Use CHMP) der Europäischen Arzneimittelagentur im Juni 2013,[7] dass in einigen Indikationen das Fibrose- und Ergotismusrisiko den Nutzen der Therapie mit Dihydroergotamin überwiege. Das Bundesinstitut für Arzneimittel und Medizinprodukte ordnete daraufhin zum 1. Februar 2014 das Ruhen der Zulassung an für Arzneimittel mit dem Wirkstoff Dihydroergotamin, die ausschließlich für die nicht mehr angezeigten Anwendungsgebiete zugelassen waren.[8] Die österreichische AGES Medizinmarktaufsicht empfahl im Juni 2013, Dihydroergotamin in den Anwendungsgebieten mit ungünstigem Nutzen-Risiko-Verhältnis nicht mehr zu verwenden.[9] In der Schweiz wurde der Vertrieb von Arzneimitteln mit Dihydroergotamin 2014 eingestellt.
Die Verabreichung erfolgt(e) oral (als Tabletten, Kapseln oder Tropfen), als Injektion (Ampullen), intranasal (als Nasenspray) oder oral durch Inhalation mittels eines speziellen Inhalators. Bei oraler Inhalation erreicht Dihydroergotamin eine höhere biologische Verfügbarkeit als bei nasaler Applikation, was sich in einer randomisierten Doppelblind-Phase-III-Studie zeigte.[10]
Nebenwirkungen
Zu den häufigsten unter Dihydroergotamin beobachteten Nebenwirkungen gehören Unruhe, Übelkeit und Kopfschmerz. Ferner können Angina Pectoris und periphere Durchblutungsstörungen auftreten.
Aufgrund schwerer und potenziell tödlicher Nebenwirkungen wie Fibrose in verschiedenen Organen und Geweben und Ergotismus (Vergiftung durch Mutterkornalkaloide) untersagte ein Rote-Hand-Brief des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) im Januar 2014 den Einsatz als Prophylaxe bei Migränekopfschmerz, bei orthostatischer Hypotonie und als symptomatische Behandlung bei venös-lymphatischer Insuffizienz.[8]
Wechselwirkungen und Gegenanzeigen
Da Dihydroergotamin über das Cytochrom-P450-Enzymsystem verstoffwechselt wird, verstärken Hemmstoffe, wie z. B. Makrolidantibiotika, die Wirkungen und Nebenwirkungen von Dihydroergotamin. Dihydroergotamin darf nicht gleichzeitig mit Triptanen (Mittel gegen Migräne) verabreicht werden.
Handelsnamen
Monopräparate
Dihydergot (A, CH) bis 2014, Ergont (A), Migranal (A)
Weblinks
- New restrictions on use of medicines containing ergot derivatives. Pressemitteilung der European Medicines Agency, 28. Juni 2013, ema.europa.eu (englisch).
- Sicherheitsinformationen Ergot Derivate. Bundesamt für Sicherheit im Gesundheitswesen (A), 28. Juni 2013, basg.gv.at
Einzelnachweise
- ↑ a b c d e f Eintrag zu Dihydroergotamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Juni 2019.
- ↑ a b Datenblatt Dihydroergotamine Mesylate bei Sigma-Aldrich, abgerufen am 28. Mai 2022 (PDF).
- ↑ Leitlinien zur Therapie der Migräne der Deutschen Gesellschaft für Neurologie, abgerufen am 3. August 2014
- ↑ S1-Leitlinie Clusterkopfschmerz und trigeminoautonome Kopfschmerzen der Deutschen Gesellschaft für Neurologie (DGN). In: AWMF online (Stand 2015)
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Dihydroergotamin-Mesilat: CAS-Nummer: 6190-39-2, EG-Nummer: 228-235-6, ECHA-InfoCard: 100.025.669, PubChem: 71171, ChemSpider: 64311, DrugBank: DBSALT000997, Wikidata: Q27126884.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Dihydroergotamin-Tartrat: CAS-Nummer: 5989-77-5, EG-Nummer: 227-816-1, ECHA-InfoCard: 100.025.287, GESTIS-Stoffdatenbank: 119399, PubChem: 3037136, ChemSpider: 2300960, Wikidata: Q27126885.
- ↑ a b New restrictions on use of medicines containing ergot derivatives; EMA Pressemitteilung vom 28. Juni 2013.
- ↑ a b Dihydroergotamin und Dihydroergotoxin: Umsetzung der Durchführungsbeschlüsse der EU-Kommission. Bundesinstitut für Arzneimittel und Medizinprodukte, 1. April 2014; abgerufen am 24. April 2014.
- ↑ Ergot Derivate (diverse Präparate) (Memento vom 6. Dezember 2016 im Internet Archive), Agentur für Gesundheit und Ernährungssicherheit#Bundesamt für Sicherheit im Gesundheitswesen, 28. Juni 2013.
- ↑ Sheena K. Aurora, Stephen D. Silberstein, Shashidhar H. Kori, Steward J. Tepper, Scott W. Borland, Min Wang, David W. Dodick: MAP0004, Orally Inhaled DHE: A Randomized, Controlled Study in the Acute Treatment of Migraine. In: Headache: The Journal of Head and Face Pain. Band 51, Nr. 4, April 2011, S. 507–517, doi:10.1111/j.1526-4610.2011.01869.x.
Auf dieser Seite verwendete Medien
Structure of dihydroergotamine.
