Decitabin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Decitabin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H12N4O4 | ||||||||||||||||||
| Kurzbeschreibung | weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | L01BC | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Wirkmechanismus | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 228,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Decitabin ist ein synthetisches Nukleosid. Das Molekül setzt sich aus β-D-Desoxyribose (Zuckerkomponente) und einem substituierten Triazin zusammen. Es ist ein chemisches Analogon des Nukleosids Desoxycytidin. Decitabin wirkt als Zytostatikum, indem es die DNA-Methyltransferase hemmt.
Eigenschaften
Das 5-Aza-2'-desoxycytidin unterscheidet sich chemisch vom Desoxycytidin, indem in der 5-Position eine C-H-Einheit formal durch ein Stickstoffatom ersetzt wird. Aus dem Pyrimidingrundgerüst wird somit ein 1,3,5-Triazingrundgerüst. Das Analogon mit Ribose ist das Azacitidin.
 |  | 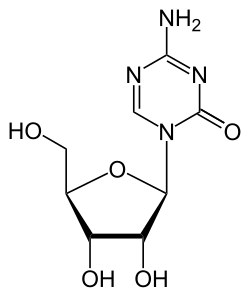 |
| Desoxycytidin, dC | Decitabin | 5-Azacytidin, 5-azaC |
Wirkungsmechanismus
Decitabin weist einen zu 5-Azacytidin vergleichbaren Wirkmechanismus auf: während der Replikation wird es in die DNA und während der Transkription in die RNA eingebaut. Dadurch werden DNA-Methyltransferasen bzw. RNA-Methyltransferasen gehemmt. Die verminderte Methylierung (Hypomethylierung) bewirkt eine Reaktivierung von Tumorsuppressor-Genen. Dadurch kann es zu einer Induktion der Zelldifferenzierung oder der Zellseneszenz kommen, gefolgt von programmiertem Zelltod (Apoptose).[3]
Therapeutische Verwendung
Decitabin wurde 2006 durch die US-amerikanische FDA als Orphan-Arzneimittel zur Therapie des Myelodysplastischen Syndroms (MDS) zugelassen. Im September 2012 folgte in der EU die Zulassung zur Behandlung von Erwachsenen über 65 Jahren, die an akuter myeloischer Leukämie (AML) erkrankt sind.[4][5]
In einer bundesweiten klinischen Studie mit über 220 Patienten, die in den Jahren zwischen 2003 und 2009 durchgeführt wurde, wurde der Einsatz von niedrig dosiertem Decitabin für die Therapie von älteren AML-Patienten untersucht. In einer weiteren Studie wurde untersucht, wie Decitabin in der Kombination mit Valproinsäure beziehungsweise dem Vitamin-A-Abkömmling Tretinoin (ATRA) im Hinblick auf eine komplette oder zumindest teilweise Remission und auf das Überleben der Patienten wirkt.[6] Es wurde ein signifikanter Überlebensvorteil in der Kombination mit ATRA nachgewiesen (8,2 Monate vs 5,1 Monate bei Decitabin alleine).[7]
Im September 2023[8] ließ die europäische Kommission die fixe Kombination von Decitabin mit Cedazuridin zur Behandlung von Erwachsenen mit neu diagnostizierter akuter myeloischer Leukämie (AML) zu, die für eine Standard-Induktionschemotherapie nicht in Frage kommen.[9]
Frühe Nutzenbewertung
Seit 2011 müssen sich neu zugelassene Medikamente mit neuen Wirkstoffen aufgrund § 35a SGB V (AMNOG) einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterziehen, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen (GKV Spitzenverband) einen Preis aushandeln. Dies gilt auch für Decitabin. Eine Beschlussfassung hinsichtlich des „Zusatznutzens“ von Decitabin durch den G-BA fand Ende April 2013 statt. Laut G-BA wurde ein geringer Zusatznutzen festgestellt.[10]
Handelspräparate
Janssen-Cilag: Dacogen (EU)
Weblinks
- Eintrag zu Decitabine in der Human Metabolome Database (HMDB), abgerufen am 15. November 2013.
- Label von Dacogen (PDF; 230 kB) FDA.
- Norbert Gattermann:Epigenetische Behandlung mit 5-Azacytidin und Decitabin ( vom 26. Juni 2022 im Internet Archive) Deutsches MDS-Forum – Duisburg 2008.
- Zulassungs-Eintrag. In: Community Register of medicinal products der Europäischen Kommission
Einzelnachweise
- ↑ a b c d Datenblatt 5-Aza-2′-deoxycytidin bei Sigma-Aldrich, abgerufen am 2. November 2021 (PDF).
- ↑ Eintrag zu Decitabine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ G. Geisslinger, S. Menzel, T. Gundermann, B. Hinz, P. Roth (Hrsg.): Mutschler Arzneimittelwirkungen. 11. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2020, S. 850.
- ↑ Zusammenfassung des EPAR für die Öffentlichkeit. (PDF; 77 kB) European Medicines Agency.
- ↑ Durchführungsbeschluss der Kommission vom 20.9.2012 über die Genehmigung für das Inverkehrbringen des Humanarzneimittels für seltene Leiden „Dacogen - Decitabine“ gemäß der Verordnung (EG) Nr. 726/2004 des Europäischen Parlaments und des Rates (PDF; 14,4 kB) Europäische Kommission.
- ↑ Benjamin Waschow: Hoffnung für ältere Patienten mit einer akuten myeloischen Leukämie. Universitätsklinikum Freiburg, Pressemitteilung vom 25. April 2012 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 24. August 2015.
- ↑ Michael Lübbert, Olga Grishina, Claudia Schmoor, Richard F. Schlenk, Edgar Jost, Martina Crysandt, Michael Heuser, Felicitas Thol, Helmut R. Salih, Marcus M. Schittenhelm, Ulrich Germing, Andrea Kuendgen, Katharina S. Götze, Hans-Walter Lindemann, Carsten Müller-Tidow, Gerhard Heil, Sebastian Scholl, Gesine Bug, Carsten Schwaenen, Aristoteles Giagounidis, Andreas Neubauer, Jürgen Krauter, Wolfram Brugger, Maike De Wit, Ralph Wäsch, Heiko Becker, Annette M. May, Justus Duyster, Konstanze Döhner, Arnold Ganser, Björn Hackanson, Hartmut Döhner, DECIDER Study Team: Valproate and Retinoic Acid in Combination With Decitabine in Elderly Nonfit Patients With Acute Myeloid Leukemia: Results of a Multicenter, Randomized, 2 × 2, Phase II Trial. In: Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. Band 38, Nr. 3, 20. Januar 2020, S. 257–270, doi:10.1200/JCO.19.01053, PMID 31794324.
- ↑ Eintrag EU/1/23/1756 im Unionsregister für Humanarzneimittel, abgerufen am 8. Oktober 2023.
- ↑ Inaqovi: Pending EC decision – European Medicines Agency. In: ema.europa.eu. 20. Juli 2023, abgerufen am 27. Juli 2023 (englisch).: Inaqovi: Pending EC decision – European Medicines Agency. In: ema.europa.eu. 20. Juli 2023, abgerufen am 27. Juli 2023 (englisch).
- ↑ G-BA trifft drei weitere Entscheidungen zu neuen Wirkstoffen. Pressemitteilung G-BA, 2. Mai 2013.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Skeletal formula of decitabine (5-aza-2'-deoxycytidine). Created using ACD/ChemSketch 10.0 and Inkscape.
Azacitidine; Azacytidine
Struktur von Desoxycytidin



