Cyclodextrine

Cyclodextrine (CD) sind eine Klasse von Molekülen, die zu den cyclischen Oligosacchariden gehören. Sie stellen ringförmige Formen von Stärke dar. Sie bestehen aus α-1,4-glycosidisch verknüpften Glucosemolekülen. Dadurch entsteht eine toroidale Struktur mit einem zentralen Hohlraum. Cyclodextrine wurden zuerst von Villiers und Schardinger beschrieben, blieben aber lange Zeit eine Laborkuriosität. Sie wurden erstmals von Villiers 1891 isoliert und 1903 von Schardinger als Oligosaccharide charakterisiert.

Nomenklatur
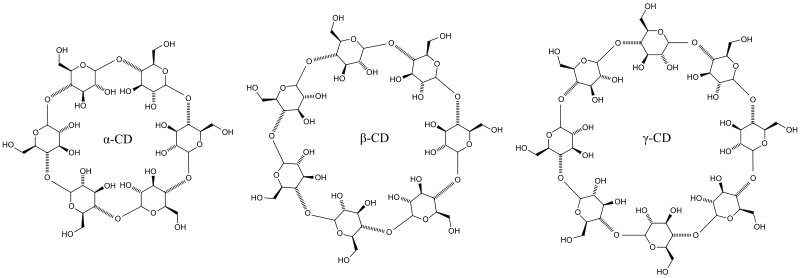
Je nach Anzahl der sie aufbauenden Glucoseeinheiten werden die Cyclodextrine unterschiedlich benannt. Mittels eines griechischen Buchstabens als Präfix unterscheidet man:
- α-Cyclodextrin: n = 6 Glucosemoleküle (Hohlraumdurchmesser/-höhe: 4,7..5,3/7,9 Å)
- β-Cyclodextrin: n = 7 Glucosemoleküle (Hohlraumdurchmesser/-höhe: 6,0..6,5/7,9 Å)
- γ-Cyclodextrin: n = 8 Glucosemoleküle (Hohlraumdurchmesser/-höhe: 7,5..8,3/7,9 Å)
- δ-Cyclodextrin: n = 9 Glucosemoleküle
Über die oben erwähnten Cyclodextrine hinaus werden in der Fachliteratur Cyclodextrine mit wesentlich mehr Glucoseeinheiten detailliert beschrieben. Diese sind allerdings aufgrund der geringen Mengen und hoher Preise nicht von ökonomischer Bedeutung. Die weiteste technische Verbreitung haben β-Cyclodextrin und Hydroxypropyl-β-Cyclodextrin. In der Lebensmittelindustrie werden α-Cyclodextrin und γ-Cyclodextrin eingesetzt. Da α-Cyclodextrin ein löslicher Ballaststoff ist, kann es als solches auch im Inhaltsverzeichnis aufgeführt sein, z. B. als Alpha-Cyclodextrin (löslicher Ballaststoff).
Gewinnung und Herstellung
Cyclodextrine werden biotechnologisch durch den enzymatischen Abbau von Stärke, etwa aus Mais oder Kartoffeln, hergestellt. Die hierfür eingesetzten Enzyme werden als Cyclodextrin-Glycosyltransferasen, kurz CGTasen bezeichnet. Diese sind in verschiedenen Bakterien und Archaeen zu finden, wobei industriell die aus dem Bacillus macerans isolierten CGTasen am bedeutsamsten sind. Bei der Einwirkung auf Stärke schneidet die CGTase aus der helikal gewundenen Struktur des Kohlenhydrats einzelne Stücke heraus und verbindet diese zu einem ringförmigen Oligosaccharid – dem Cyclodextrin. Industriell interessant ist insbesondere die sortenreine Gewinnung von Cyclodextrinen, um die verschiedenen Hohlraumdurchmesser je nach einzuschließender Substanz auswählen zu können. Es stehen selektive Enzyme zur Verfügung, die jeweils gezielt α-, β- und γ-Cyclodextrin produzieren. Dies ist besonders für die Lebensmittelindustrie von Bedeutung, da nur α- und γ-Cyclodextrin unbegrenzt verzehrt werden sollten.
Eigenschaften
Allen niederen Cyclodextrinen eigen ist die hydrophobe Kavität im Innern und die polare Außenfläche. Dadurch sind die Cyclodextrine in der Lage, sogenannte Einschlussverbindungen mit apolaren organischen Verbindungen zu bilden.
In alkalischen sowie in sauren Lösungen bis pH 2 sind Cyclodextrine sehr stabil. Sie haben keine festen Schmelzpunkte, sind aber bis etwa 200 °C stabil. Darüber beginnen sie sich zu zersetzen. Sie gelten als ungiftig und sind weitgehend stabil gegenüber menschlichen Verdauungsenzymen, weshalb α-Cyclodextrin auch als löslicher Ballaststoff eingesetzt werden kann.
Verwendung
Die Fähigkeit zu Einschlussverbindungen mit apolaren organischen Verbindungen und die Wasserlöslichkeit machen Cyclodextrine zu einem immer wichtigeren Gegenstand der pharmazeutischen Forschung, da die Komplexe mit Pharmazeutika in der Regel besser wasserlöslich sind als die reinen Pharmazeutika und daher auch im Körper leichter verfügbar sind. So erleichtern sie als Bestandteil von Augentropfen den Transport des meist lipophilen Medikamentes durch die hydrophile Tränenflüssigkeit zur lipophilen Augenmembran.[1] Weiterhin ist ihre Fähigkeit, die eingeschlossene Substanz vor umgebenden Verbindungen (zum Beispiel Sauerstoff) zu schützen sowie die eingeschlossenen Substanzen über einen längeren Zeitraum abzugeben, von großem Interesse.
α-Cyclodextrin ist seit 2008 in der Europäischen Union als lösliche Nahrungsfaser zugelassen.[2] Im Juni 2013 hat die Kommission der Europäischen Union α-Cyclodextrin einen nachweislich gesundheitsfördernden Effekt (Health Claim) bescheinigt. Das EU-Gutachten bestätigt, dass α-Cyclodextrin den Blutzuckeranstieg nach stärkehaltigen Mahlzeiten verringern kann.[3] Aufgrund seiner oberflächenaktiven Eigenschaften findet es Einsatz als emulgierende Phase in der Lebensmittel- (Mayonnaisen) und Kosmetikindustrie (Hautcremes) sowie als Aufschlagmittel für Desserts, Süß- und Backwaren. β-Cyclodextrin ist in der EU als Lebensmittelzusatzstoff der Nummer E 459 mit unterschiedlichen Höchstmengenbeschränkungen für bestimmte Lebensmittel zugelassen, im Einzelnen bei der Aromatisierung von Tees oder Instant-Getränkepulvern (mit 0,5 g/kg in der vorgesehenen Verzehrzubereitung) und Knabbererzeugnissen (mit 1 g/kg) sowie bei tablettierten Lebensmitteln (nach Bedarf – quantum satis).[4] Gamma-Cyclodextrin wurde von der EU für die Wacker Chemie AG als neuartige Lebensmittelzutat für Nahrungsmittel- und Getränkeanwendungen zugelassen.[5]
Darüber hinaus begegnen dem Verbraucher Cyclodextrine unter dem Handelsnamen Febreze, Bounce oder Oust. Die in diesen Produkten befindlichen Cyclodextrinderivate binden die für unangenehme Gerüche verantwortlichen Verbindungen und sind gleichermaßen Träger von Duftstoffen. In manchen Ländern (zum Beispiel USA, Japan) sind Cyclodextrine als Lebensmittelzusatzstoffe zugelassen, da sie unter anderem den Geschmack und Geruch der eingeschlossenen Substanzen aufheben oder wieder freigeben können. Das Einsatzspektrum von Cyclodextrinen umfasst heute von verschiedenen Medikamentenzubereitungen über Pappkartons bis hin zur Medizin, Landwirtschaft und Sensorik diverse Einsatzbereiche. Das deutsche Textilforschungsinstitut in Krefeld erforscht intensiv die Nutzung von kovalent an die Stofffasern gebundenen Cyclodextrinen für „intelligente“ Textilien. Diese können sowohl über die Haut aufzunehmende Medikamente enthalten als auch Schweißgeruch binden.
In der analytischen Chemie und mit besonders großem Erfolg in der Gaschromatographie werden spezielle Cyclodextrinderivate eingesetzt, um Gemische von Enantiomeren zu trennen. Ebenso erfolgreich sind Cyclodextrinderivate in der Kapillarelektrophorese (englisch CE) etabliert. Mit sulfatierten, geladenen Cyclodextrinen wird dadurch sogar eine Trennung von neutralen Enantiomeren möglich, die mittels CE ansonsten nicht zugänglich wären.[6]
Modifizierte Cyclodextrine stellten sich einer Veröffentlichung im Jahr 2020 zufolge als viruzid wirksam heraus; eine Weiterentwicklung zu Medikamenten oder Desinfektionsmitteln ist denkbar.[7][8]
Derivate
Durch Derivatisierung von Cyclodextrinen können verschiedene Eigenschaften dieser Verbindungen entscheidend verbessert werden. Die meisten Derivatisierungen erfolgen an den Hydroxylgruppen dieser Oligosaccharide. Durch die Derivatisierung von β-Cyclodextrin kann dessen geringe Löslichkeit wesentlich verbessert werden. In Verwendung sind vor allem Sulfobutyl-β-Cyclodextrin, 2-Hydroxypropyl-β-Cyclodextrin und Methyl-β-Cyclodextrin. Des Weiteren weist auch 2-Hydroxypropyl-γ-Cyclodextrin eine höhere Löslichkeit als γ-Cyclodextrin auf.[9] Zudem können Cyclodextrinen durch die kovalente Bindung von Thiolteilstrukturen mukoadhäsive Eigenschaften verliehen werden, da diese mit Cystein-reichen Untereinheiten von Mukus Glykoproteinen Disulfidbrücken ausbilden (siehe Thiomere). Die Verweilzeit von Cyclodextrinen und darin eingelagerten Wirkstoffen an Schleimhäuten kann dadurch wesentlich verlängert werden.[10][11] Zudem werden thiolisierte Cyclodextrine aktiv von Zellen aufgenommen. Die zelluläre Aufnahme von verschiedenen Wirkstoffen kann beispielsweise durch thiolisiertes α-Cyclodextrin um bis zu 20-fach verbessert werden.[12]
Literatur
- A. Villiers: Sur la transformation de la fécule en drextrine par le ferment butyrique. In: Compt. Rend. Fr. Acad. Sci. 1891, S. 435–438.
- A. Biwer, G. Antranikian, E. Heinzle: Enzymatic production of cyclodextrins. In: Appl Microbiol Biotechnol. 59, 2002, S. 609–617. PMID 12226716.
Einzelnachweise
- ↑ Avoxa-Mediengruppe Deutscher Apotheker GmbH: Cyclodextrine: Wundertüten in Pharmazie und Alltag. Abgerufen am 28. Januar 2021.
- ↑ Genehmigung des Inverkehrbringens von α-Cyclodextrin als neuartige Lebensmittelzutat (2008/413/EG).
- ↑ Verordnung (EU) Nr. 536/2013 der Kommission vom 11. Juni 2013 zur Änderung der Verordnung (EU) Nr. 432/2012 zur Festlegung einer Liste zulässiger anderer gesundheitsbezogener Angaben über Lebensmittel als Angaben über die Reduzierung eines Krankheitsrisikos sowie die Entwicklung und die Gesundheit von Kindern (Text von Bedeutung für den EWR) (Anhang, 10(6), 2012, S. 2713 | 2926 |).
- ↑ Verordnung (EG) Nr. 1333/2008 in der konsolidierten Fassung vom 31. Oktober 2022
- ↑ WACKER erhält Zulassung von gamma-Cyclodextrin als neue Lebensmittelzutat für Nahrungsmittel und Getränke in der EU. Presseinformation Wacker Chemie AG, 28. Juni 2012.
- ↑ C. Bicchi: Cyclodextrin derivatives as chiral selectors for direct gas chromatographic separation of enantiomers in the essential oil, aroma and flavour fields. In: Journal of Chromatography A. 843, 1999, S. 99–121; online abgerufen am 1. Januar 2013.
- ↑ Modifizierte Zuckermoleküle vernichten Viren, derstandard.at vom 30. Jänner 2020.
- ↑ Jones ST, Cagno V, Stellacci F, Tapparel C et al.: Modified cyclodextrins as broad-spectrum antivirals, in: Science Advances, Vol. 6, no. 5, eaax9318 vom 29. Januar 2020. doi:10.1126/sciadv.aax9318 (englisch).
- ↑ T Loftsson, M Brewster, M Másson: Role of cyclodextrins in improving oral drug delivery. In: Am. J. Drug Deliv. 2. Jahrgang, 2004, S. 261–275, doi:10.2165/00137696-200402040-00006 (englisch).
- ↑ G Kali, S Haddadzadegan, F Laffleur, A Bernkop-Schnürch: Per-thiolated cyclodextrins: Nanosized drug carriers providing a prolonged gastrointestinal residence time. In: Carbohydrate Polymers. 300. Jahrgang, 2023, S. 120275, doi:10.1016/j.carbpol.2022.120275, PMID 36372469 (englisch).
- ↑ B Grassiri, P Knoll, A Fabiano, AM Piras, Y Zambito, A Bernkop-Schnürch: Thiolated Hydroxypropyl-β-cyclodextrin: A Potential Multifunctional Excipient for Ocular Drug Delivery. In: International Journal of Molecular Sciences. 23. Jahrgang, Nr. 5, 2022, S. 2612, doi:10.3390/ijms23052612, PMID 35269753, PMC 8910138 (freier Volltext) – (englisch).
- ↑ Ö Kaplan, M Truszkowska, G Kali, P Knoll, M Blanco Massani, DE Braun, A Bernkop-Schnürch: Thiolated α-cyclodextrin: The likely smallest drug carrier providing enhanced cellular uptake and endosomal escape. In: Carbohydrate Polymers. 316. Jahrgang, 2023, S. 121070, doi:10.1016/j.carbpol.2023.121070 (englisch).
Weblinks
- Martin Gröger, Eva Katharina Kretzer, Andreas Woyke: Cyclodextrine. (Memento vom 3. März 2012 im Internet Archive) Universität Siegen, 2001. (Ausführliche Übersicht über Cyclodextrine; PDF, 1,52 MB)
- CTD, Inc, Cyclodextrin Resource (Memento vom 1. Februar 2011 im Internet Archive) (englisch)
Auf dieser Seite verwendete Medien
Autor/Urheber: Stanisław Skowron, Lizenz: CC BY-SA 3.0
Chemical structure of the three main types of cyclodextrins.


