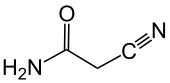
Cyanacetamid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cyanacetamid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H4N2O | ||||||||||||||||||
| Kurzbeschreibung | schwach gelblicher bis weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 84,077 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 1,061–1,062g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Cyanacetamid ist ein Feststoff und ein Derivat der Essigsäure. Es weist als Amid der Cyanessigsäure eine Nitril-, eine CH-acide Methylengruppe und eine Amidfunktion im Molekül auf.
Gewinnung und Darstellung
Cyanacetamid wird durch Umsetzung von Cyanessigsäureethylester mit konzentriertem wässrigem Ammoniak in 86–88%iger Ausbeute erhalten.[1]
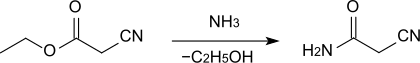
Eine neuere Synthese ist die Umsetzung von Halogenacetamiden mit Alkalicyaniden in Gegenwart von Wasser.[4]
Chemische Eigenschaften
Die aciden Wasserstoffatome im Cyanacetamid reagieren leicht mit Formaldehyd oder mit Halogenen. Wegen seiner Reaktivität und Multifunktionalität ist Cyanacetamid ein Ausgangsstoff beispielsweise für die Synthese von Heterocyclen.
Verwendung
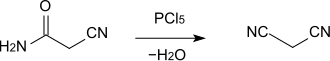
Cyanacetamid dient als Ausgangsstoff für die Herstellung von Malonsäuredinitril, wobei die Amidgruppe durch Reaktion mit Phosphorpentachlorid (PCl5) oder Phosphorylchlorid (POCl3) zur Nitrilgruppe dehydratisiert wird.[5] Die Reaktion kann auch in 1,2-Dichlorethan als Lösemittel durchgeführt werden.[6]
Die Umsetzung mit Brom führt zum – inzwischen obsoleten – Biozid 2,2-Dibromcyanacetamid DBNPA.

Die Cyclokondensation von 1,3-Diketonen mit Cyanacetamid liefert in einer Guareschi-Thorpe-Reaktion 3-Cyano-2-pyridone. Nachfolgende Hydrolyse der Cyanogruppe in wässriger Säure, Decarboxylierung, Chlorierung und katalytische Hydrierung führt zu 2,4-Dialkylpridinen.[7]

Ein Syntheseweg zum Gichtmittel Allopurinol geht von Cyanacetamid aus, das mit Formamidin und nachfolgendem Ringschluss mit Hydrazin ein substituiertes Pyrazol ergibt, das mit Formamid zum Pyrazolo-pyrimidin Allopurinol cyclisiert wird.[8]
In den Synthesen der Antituberkulotika Ethionamid und des homologen Prothionamid dient Cyanacetamid als Edukt.
Einzelnachweise
- ↑ a b c d B. B. Corson, R. W. Scott, and C. E. Vose: Cyanoacetamide In: Organic Syntheses. 9, 1929, S. 36, doi:10.15227/orgsyn.009.0036; Coll. Vol. 1, 1941, S. 179 (PDF).
- ↑ a b c Datenblatt Cyanacetamid bei Merck, abgerufen am 13. Februar 2010.
- ↑ a b Datenblatt Cyanoacetamide bei Sigma-Aldrich, abgerufen am 24. Februar 2018 (PDF).
- ↑ Patent DE2538254C2: Verfahren zur Herstellung von Cyanacetamiden. Angemeldet am 28. August 1975, veröffentlicht am 7. Juni 1984, Anmelder: BASF AG, Erfinder: Hans-Jürgen Quadbeck-Seeger.
- ↑ B. B. Corson, R. W. Scott, and C. E. Vose: Malononitrile In: Organic Syntheses. 10, 1930, S. 66, doi:10.15227/orgsyn.010.0066; Coll. Vol. 2, 1943, S. 379 (PDF).
- ↑ Alexander R. Surrey: Malononitrile In: Organic Syntheses. 25, 1945, S. 63, doi:10.15227/orgsyn.025.0063; Coll. Vol. 3, 1955, S. 535 (PDF).
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. 5., überarb. Auflage. Thieme, Stuttgart, New York 2005, ISBN 3-13-541505-8.
- ↑ A. Kleemann, J. Engel: Pharmazeutische Wirkstoffe, 2. Aufl., Georg Thieme, Stuttgart - New York, 1982.
Auf dieser Seite verwendete Medien
Autor/Urheber: MegaByte07, Lizenz: CC BY-SA 3.0
Dehydratation_Cyanacetamide
Cyanacetamid_Strukturformel
Autor/Urheber: MegaByte07, Lizenz: CC BY-SA 3.0
Bromination_Cyanacetamide
Autor/Urheber: MegaByte07, Lizenz: CC BY-SA 3.0
Cyclisation_Cyanacetamide





