Choanozoa
| Choanozoa | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Oben: Eine Zellkolonie des Choanoflagellaten Salpingoeca rosetta. Ein mariner Schwamm. Eine Rippenqualle der Art Bathocyroe fosteri. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Choanozoa | ||||||||||||
| Brunet & King, 2017 |
Zu der Gruppe der Choanozoa gehören alle vielzelligen Tiere (Metazoa) und ihre nächsten Verwandten, die Kragengeißeltierchen (Choanoflagellata). Es zählen sämtliche Lebensformen dazu, die den Zelltyp der Kragengeißelzelle (Choanocyt) ausbilden oder deren Vorfahren wahrscheinlich einmal diesen Zelltyp ausgebildet haben.
Bei den Kragengeißeltierchen handelt es sich um mikroskopisch kleine Eukaryoten, die praktisch immer wie Kragengeißelzellen aussehen. Die meiste Zeit über bestehen die einzelligen Organismen und wenigzelligen Zellkolonien aus solchen Zellen. Unter heutigen Tieren werden Kragengeißelzellen nur noch bei den Schwämmen (Porifera) vorgefunden, bei allen anderen gingen sie verloren. Die übrigen Tiere haben heutzutage also keine Kragengeißelzellen mehr. Stattdessen besitzen viele von ihnen immer noch recht ähnliche Zelltypen.
Die Stammesgeschichte der Choanozoa reicht vermutlich fast eine Milliarde Jahre zurück. Sie begann mit der Evolution der Kragengeißelzellen. Für die ersten paar hundert Millionen Jahre dieser Stammesgeschichte wurden bisher allerdings keine oder lediglich umstrittene fossile Belege erbracht.
Begriff

st = Stiel
c = Kragen
f = Geißel
Im Jahr 1765 veröffentlichte der britische Naturforscher John Ellis eine Untersuchung an Schwämmen. Ihm fiel auf, dass sie einen Nahrungsstrom auf aktive Weise erzeugten und dabei den Bereich um ihre zentrale Ausstromöffnung (Osculum) selbstständig bewegten. Damit lieferte Ellis’ Veröffentlichung zwei Belege, um Schwämme gut begründet in die Gruppe der Tiere zu ordnen.[1][2] Der deutsche Naturforscher Christian Gottfried Ehrenberg beschrieb im Jahr 1831 mit dem „vielköpfigen Säulenglöckchen“ einen Mikroorganismus,[3] der mit einiger Wahrscheinlichkeit heute der Art Codosiga botrytis zugeordnet wird. Somit hatte Ehrenberg die Kragengeißeltierchen entdeckt.[4][5] Eine erste eindeutige Abbildung folgte zwar erst über zwei Jahrzehnte später durch den deutschen Botaniker Georg Fresenius,[6][7][8] doch bereits kurz nach Ehrenbergs Veröffentlichung erkannte der französische Naturforscher Félix Dujardin die große Ähnlichkeit zwischen diesen Organismen und bestimmten Zellen von Schwämmen. Er taufte jene Zellen Choanocyten.[9] Mit Choanoflagellaten und Choanocyten beschäftigte sich etwas später auch der US-amerikanische Biologe Henry James Clark. Er war der Erste, der sich für eine verwandtschaftliche Beziehung zwischen Kragengeißeltierchen und Schwämmen aussprach.[10] Sieben Jahre danach stellte schließlich der britische Biologe Thomas Henry Huxley die Porifera einerseits an die Basis der Metazoa und andererseits gleichzeitig allen übrigen Tieren gegenüber.[11][2][12]
Schon im letzten Drittel des 19. Jahrhunderts war bekannt, dass die Schwämme einfach gebaute Tiere darstellen und dass sie mit den Kragengeißeltierchen wahrscheinlich in enger verwandtschaftlicher Beziehung stehen. Demzufolge waren bereits die Voraussetzungen gegeben, um Tiere und Kragengeißeltierchen als eine gemeinsame geschlossene Abstammungsgemeinschaft anzusehen. Diese Gemeinschaft erhielt jedoch für über einhundertzwanzig Jahre keinen eigenen Namen. Darüber hinaus wurden seit dem Beginn der Phylogenomik beständig weitere Belege geliefert, die für ein Monophylum aus Choanoflagellata und Metazoa sprachen.[13][14][15]
Um dieses Monophylum zu benennen, wurde versuchsweise vorgeschlagen, die Kragengeißeltierchen schlicht ebenfalls als Tiere anzusehen.[16] Daraus hätte eine Gruppe namens „Animalia“ resultiert, die in sich Choanoflagellata und Metazoa gesammelt hätte. Diese Möglichkeit fand keine weite Verbreitung. Denn das Wort Animalia hatte sich längst mit einer anderen Wortbedeutung etabliert, es wird als Synonym für das Wort Metazoa benutzt.[17] Sehr häufig blieb das Monophylum schlicht namenlos. Nur gelegentlich wurden weitere Namensvorschläge unterbreitet, die „Choanimal“[18] und „Apoikozoa“[19] hießen. Beide setzten sich nicht durch. Im Jahr 2017 brachten die US-amerikanischen Biologen Thibaud Brunet und Nicole King das Wort „Choanozoa“ als neue Bezeichnung für die Klade aus Kragengeißeltierchen und Tieren ein.[20] Es war zwar schon einmal acht Jahre vorher mit der genau gleichen Wortbedeutung in einer Abbildung aufgetaucht,[21] hatte damals jedoch keine weitere Aufmerksamkeit erfahren. Außerdem war „Choanozoa“ in den Jahren 1981 und 1983 von dem britischen Evolutionsbiologen Thomas Cavalier-Smith als eine Benennung für einen Stamm vorgeschlagen worden, der ausschließlich die Kragengeißeltierchen umfasst hätte.[22] Dadurch war die Bezeichnung seit den 1980ern längst zu einem weitgehenden Synonym für das Wort Choanoflagellata geworden. Im Wortsinn von Cavalier-Smith wurde „Choanozoa“ bis in die 2000er Jahre verwendet.[23] Dann stellten Thibaut Brunet und Nicole King ihre neue Bedeutung des Begriffs vor. Sie argumentierten außerdem, dass „Choanozoa“ in der Verwendung von Cavalier-Smith ein Paraphylum beschreiben würde. Denn die Bezeichnung hätte in ihrer damals aktuellsten Fassung aus dem Jahr 2008 noch zwei weitere Einzeller-Gruppen einbezogen, die Ichthyosporea und die Filasterea.[20] Die revidierte Klassifikation der Eukaryoten aus dem Jahr 2019 griff den Nomenklatur-Vorschlag von Thibaud Brunet und Nicole King auf. Ihr zufolge trägt die monophyletische Gruppe aus Kragengeißeltierchen (Choanoflagellata) und Tieren (Metazoa) nun den Namen Choanozoa.[24]
Merkmal
Das zelluläre Merkmal der Choanozoa besteht in der Kragengeißelzelle. Es wird häufig als ein gemeinsames abgeleitetes Merkmal (Autapomorphie) angesehen.[25] Die Zelle trägt an einem Zellpol eine einzige Geißel. Sie ist umgeben von dem namensgebenden „Kragen“ – einem Kranz aus Stereovilli, die zwischen sich einen feinen Vorhang aus Schleim aufspannen.[26] Das Zusammenspiel von Geißel und Kragen dient der filtrierenden Ernährung. Die schlagende Geißel erzeugt einen Wasserstrom. Das zuströmende Wasser tritt durch den Schleimvorhang. Im Wasser befindliche Nahrungspartikel werden vom Schleim aufgehalten, anschließend durch Scheinfüßchen (Filopodien) eingefangen[27] und daraufhin mittels Endozytose von der Kragengeißelzelle aufgenommen.[28]

Kragengeißeltierchen sind aus einer Kragengeißelzelle aufgebaut, daneben gibt es auch kleine Zellkolonien aus mehreren Kragengeißeltierchen.[29] Im Gegensatz zu den Kragengeißeltierchen bestehen Tiere aus vielen Zellen. Unter ihnen besitzen die Schwämme die Choanocyten als einen von mehreren Zelltypen.[30] Bei den übrigen Tieren erfuhren die Kragengeißelzellen wahrscheinlich verschiedene Abwandlungen oder gingen im Verlauf der Evolution gänzlich verloren.[31]
Häufig wird davon ausgegangen, dass die Kragengeißelzelle vom letzten gemeinsamen Vorfahren aller heutigen Choanozoa entwickelt worden ist.[32] Das würde heißen, dass die Kragengeißelzellen der Kragengeißeltierchen und die Kragengeißelzellen der Schwämme miteinander homolog sind. Trotz aller großen Ähnlichkeiten besitzen beide Zelltypen aber auch eine ganze Reihe feiner Unterschiede.[33] Solche Verschiedenheiten können Gründe liefern, um die Übereinstimmung (Homologie) der Zelltypen für weniger überzeugend zu halten.[34] Vielleicht konnten sich die beiden Kragengeißelzellen auch unabhängig voneinander konvergent entwickeln.[35][36]
Systematik

Äußere Systematik der Choanozoa | |||||||||||||||||||||
| |||||||||||||||||||||
| Innere Systematik der Choanozoa | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Gemäß phylogenomischer Studien besteht die Verwandtschaft der Choanozoa aus Einzellern von sehr vielgestaltigem Aussehen.[37] Das Schwestertaxon stellen die Gruppe der Filasterea. Mit ihnen bilden sie die Abstammungsgemeinschaft der Filozoa. Die Filozoa werden mit den Teretosporea zusammengefasst zu den Holozoa.[38][39] Zu den Teretosporea gehören wiederum die häufig parasitisch lebenden Ichthyosporea und die Pluriformea[40] (synonym Corallochytrea[41]). Von der letztgenannten Gruppe wurden bisher (Stand 2017) nur ein mariner Einzeller der Gattung Corallochytrium[42] und ein limnischer Einzeller der Gattung Syssomonas entdeckt.[43] Diese aktuelle Systematik ersetzt eine etwas ältere und konkurrierende Hypothese, nach der die Pluriformea nicht als Teil der Teretosporea aufgefasst werden, sondern als Schwestertaxon der Filozoa.[44] Die Choanozoa selbst gliedern sich in Kragengeißeltierchen und Tiere. Jede der beiden Gruppen kann für sich wiederum zweigeteilt werden.[45][46]
Choanoflagellata
Choanoflagellaten der ersten Ordnung heißen Craspedida. Sie umhüllen ihre Zellen mit organischen Verbindungen, die meistens eine Theca formen. Wenige überziehen sich aber auch mit einem feinen Schleimfilm, der in ihrem Fall als Glykokalyx bezeichnet wird. Kragengeißeltierchen der zweiten Ordnung werden Acanthoecida genannt. Sie umgeben ihre Zellen mit einem Spangenkorb, der vor allem aus Siliciumdioxid aufgebaut wird und Lorica heißt.[47] Kragengeißeltierchen bilden sowohl freischwimmende als auch sessile Formen[48][49] und kommen als Einzelzellen oder in kleinen Zellkolonien vor.[29] Ihre eiförmigen bis rundlichen Zellkörper haben wenige bis höchstens einige zehn Mikrometer Durchmesser.[50] Sie gedeihen in den Meeren und im Brackwasser sowie in Süßgewässern einschließlich Bodenwässern und Aquiferen.[51] Kragengeißeltierchen ernähren sich als Filtrierer[52] von Bakterien[53] und Viruspartikeln.[54]
Metazoa
Während Kragengeißeltierchen nur als Einzeller oder in winzigen Zellkolonien leben, entwickelten Tiere eine eigene Form von Vielzelligkeit.[55] Ihre Körper bestehen aus vielen bis sehr vielen Zellen und immer aus mehreren differenzierten Zelltypen.[56] Die Vielzelligkeit der Tiere stellt einen gänzlich eigenständigen evolutionären Weg dar und entstand konvergent zu den anderen Vielzelligkeiten der Pilze, Schleimpilze, Eipilze, Armleuchteralgen, Landpflanzen, Rotalgen und Braunalgen.[57] Als ein Alleinstellungsmerkmal verfügen die Tiere über Gene, um Strukturproteine aus der Gruppe der Kollagene herzustellen.[58][59] Sie werden häufig in Extrazellularräumen der vielzelligen Organismen verwendet.[58] Die zwei Gruppen der Tiere[60][61] umfassen wahrscheinlich einerseits die Schwämme (Porifera) und möglicherweise andererseits – aber das ist nicht unumstritten – die Gruppe der Epitheliozoa.[62]
Die Zellverbände der Schwämme haben kaum Ähnlichkeiten mit den Geweben der übrigen Tiere.[63] Allerdings kommunizieren ihre Zellen untereinander mit den Nervenbotenstoffen (Neurotransmittern) namens Acetylcholin, Glutaminsäure und γ-Aminobuttersäure.[64] Außerdem enthalten die Zellleiber vom Zelltyp der Pinacocyten und von bestimmten weiteren Zellen, die manchmal nicht ganz zutreffend[65] „Myozyten“ genannt werden,[66][67] Mikrofilamente aus Actomyosin. Mit solchen fadenförmigen Protein-Strukturen vollführen die Zellen koordinierte Kontraktionsbewegungen.[68] Bis auf wenige Ausnahmen[69] ernähren sich Schwämme von Bakterien,[70] die sie mit Hilfe der Kragengeißelzellen aus dem Wasser filtern.[71]
Die Epitheliozoa differenzieren keine Choanocyten aus. Stattdessen finden sich bei vielen von ihnen bloß Zellen, die zumindest entfernt an Kragengeißelzellen erinnern.[72][31] Alle Epitheliozoa differenzieren als gemeinsames Merkmal Deckgewebe (Epithelien).[73] Die Deckgewebe-Zellen sind untereinander mit Hilfe von Desmosomen in sogenannten Adhärenzzonen[74] (Zonulae Adhaerentes) fest verbunden.[75] Die kragengeißelzell-ähnlichen Zellen sitzen in den Deckgeweben und erfüllen zum Beispiel sensorische Funktionen.[76]
Trotz des Fehlens von Kragengeißelzellen gehören Epitheliozoa zu den Choanozoa. Denn dieses Taxon wird primär phylogenomisch bestimmt: Erstens werden die Kragengeißeltierchen mit den Tieren zusammengefasst zur Gruppe der Choanozoa. Dies geschieht wegen bestimmter Gemeinsamkeiten in ihren Genomen. Zweitens werden die Schwämme mit den Epitheliozoa zusammengefasst zur Gruppe der Tiere und das passiert ebenfalls vordringlich aufgrund gewisser genomischer Übereinstimmungen. Demzufolge gehören alle Tiere gleichzeitig auch zu den Choanozoa. Insgesamt weisen die Choanozoa untereinander größere genomische Ähnlichkeiten auf als mit allen anderen Lebensformen.[13][14][15]
Evolution
Die Evolution der Choanozoa ist ein Teil der Evolution der Tiere. Aus der Entwicklung stechen zwei Ereignisse besonders heraus. Das erste besteht in der Ausformung der charakteristischen Kragengeißelzellen (Choanozyten),[32][36] das zweite in der Ausbildung der tierischen Variante einer Vielzelligkeit.[77][78] Beide Ereignisse geschahen wahrscheinlich mit fragilen einzelligen Lebensformen beziehungsweise mit weichen und sehr wenigzelligen Organismen.[32][77] Sie fanden möglicherweise schon vor mehr als 900 Millionen Jahren im unteren Proterozoikum statt[79] und hinterließen anscheinend keine fossilen Spuren.
Urchoanozoa

Falls die Kragengeißelzelle als gemeinsames ursprüngliches Merkmal aller Choanozoa angesehen wird, hätte die Evolution der Choanozoa mit der Entwicklung der Kragengeißelzelle begonnen. Dies hätte innerhalb einer Population einfach begeißelter Einzeller aus der Gruppe der Filozoa geschehen müssen.[32] Vermutlich besaßen jene Organismen eine Form von Filopodien, für die der Name „Filodigiti“ vorgeschlagen worden ist.[32] Es handelt sich um fadenartige und stets unverzweigte Zellausläufer, die auf ihrer gesamten Länge die gleiche Dicke aufweisen und sich an den Enden nicht verjüngen.[80] Filopodien kommen bis heute bei vielen Einzellern und bei bestimmten Zelltypen gewisser Vielzeller vor.[81][82] Auch rezente Choanoflagellaten bilden Filopodien.[83] Solche Zellausläufer erhalten ihre Form durch ein inneres Gerüst aus Mikrofilamenten. Sie bestehen aus zehn bis dreißig parallelen Strängen des Strukturproteins Aktin.[84] Möglicherweise wurden einige Filopodien verkürzt zu Stereovilli. Die Stereovilli wurden ringförmig um die Geißel angeordnet und formten den Kragen der Kragengeißelzelle.[32] So könnten die Urchoanoza die typischen Kragengeißelzellen evolviert haben.[31] Ihre Genome wiesen bereits 16[85] von insgesamt 29 sogenannter Syntänien auf, die heute als gemeinsames genetisches Erbe unter den Tieren gefunden werden können.[86] Wahrscheinlich lebten die Urchoanozoa sessil und ähnelten heutigen Kragengeißeltierchen aus der Gruppe der Craspedida.[32] Gemäß einer molekularen Uhr könnten sich die Urchoanozoa vor ungefähr 980 Millionen Jahren von den übrigen Filozoa getrennt haben.[79] Die Erde befand sich in der neoproterozoischen Periode des Toniums und der Superkontinent Rodinia begann in kleinere Landmassen zu zerbrechen.[87] Der Sauerstoff-Gehalt der Erdatmosphäre belief sich auf weniger als einem Hundertstel des heutigen Werts.[88]
Cadherine
Innerhalb der Choanozoa entwickelte sich ein Weg zur Vielzelligkeit. Nach der molekularen Uhr könnte dieses Ereignis vor gut 930 Millionen Jahren stattgefunden haben.[79] Diese Vielzelligkeit basiert entscheidend auf bestimmten Adhäsionsproteine (Proteine, die Kontakte zwischen Zellen vermitteln) aus der Gruppe der Cadherine.[89] Die Eiweiße sind in der Zellmembran verankert und ragen hinaus in den Extrazellularraum. Dort binden sie mit den Cadherinen benachbarter Zellen. Auf diese Weise können vielzellige Verbände entstehen.[90] Die Gene für die Proteinbiosynthese der ersten Cadherine entstanden bei Einzellern aus der Gruppe der Holozoa, noch bevor sich unter ihnen die Urchoanozoa entwickelt hatten[91] – sie wurden beispielsweise auch bei den sphärischen Kolonien von Salpingoeca rosetta gefunden.[92] Mikrofossilien der Gattung Bicellum stellen vermutlich Zellaggregate solcher eigentlich einzellig lebenden Organismen dar. Vor ungefähr einer Milliarde Jahren konnten sie sich mit Hilfe ihrer Cadherine zu vorübergehenden Zell-Zusammenballungen verbinden.[93] Die Evolution der Cadherine schritt weiter voran. Ihre Gene duplizierten, diversifizierten und tauschten Gensequenzen für Proteindomänen mit anderen Genen.[94] Wahrscheinlich kam es auch zu einem horizontalen Gentransfer, zu der Übertragung von genetischem Material, mit Prokaryoten. Es wurde die Gensequenz einer Proteindomäne übertragen, die bei heutigen Bakterien der Gattung Clostridium im Cellulosom vorkommt. Dieser Enzymkomplex bewerkstelligt den enzymatischen Cellulose-Abbau.[95] Die Urchoanoza hatten bereits Cadherine von drei Proteinfamilien entwickelt.[96] Heute werden diese Eiweiße selbst von den einzellig lebenden Choanoflagellaten der Gattung Monosiga synthetisiert.[90] Somit sollten Cadherine ursprünglich nicht zum Zusammenhaften von Zellen gedient, sondern andere Funktionen besessen haben.[95] Das änderte sich, als die ersten klassischen Cadherine evolvierten. Die klassischen Cadherine stellten eine weitere und neue Familie der Cadherine dar.[90] Erst diese neuen Eiweiße gestatteten dauerhafte Zellzusammenhalte und somit Vielzelligkeit.[32] Tatsächlich finden sich heute die Gene der klassischen Cadherine ausschließlich in den Genomen von Tieren.[97] Die Zelladhäsion der klassischen Cadherine ermöglichte die Evolution der vielzelligen Tiere aus Choanoflagellaten.[98][99]
Urmetazoa
Vermutlich erfolgte der Übergang von den Kragengeißeltierchen zu den Tieren durch bestimmte Zellkolonien aus der Stammgruppe der Choanoflagellaten, die klassische Cadherine synthetisieren konnten. Durch diese Eiweiße wären die einzelnen Zellen fest miteinander verbunden gewesen. Der Übergang zur Mehr- und schließlich zur Vielzelligkeit wäre gewährleistet gewesen.[77] Er hätte die ersten Tiere hervorgebracht, die „Urmetazoa“ genannt werden.[100] Mit der Evolution der tierischen Vielzelligkeit ging wahrscheinlich die Entwicklung der ersten Kollagene einher.[101] Eine Kollagen-Variante namens Kollagen IV gilt als die evolutionär älteste Form.[102] Von ihr lässt sich auch das nahe verwandte, kollagenähnliche Strukturprotein Spongin ableiten, das in Schwämmen vorkommt.[103]
Wahrscheinlich stellte Vielzelligkeit eine Angepasstheit gegen Fressfeinde dar.[104] Dies konnte in Experimenten belegt werden. Zum Beispiel wurden einzellige Grünalgen der Art Scenedesmus acutus in einem Aquarium gehalten. In ihr Becken wurden dann Wasserflöhe der Gattung Daphnia gesetzt, die sich von den Grünalgen ernährten. Nach mehreren Tagen wurde beobachtet, dass die Grünalgen zunehmend Zellkolonien bildeten.[105] In einem anderen Experiment wurden einzellige Grünalgen der Art Chlamydomonas reinhardtii mit Fressfeinden der Art Paramecium tetraurelia zusammengebracht. Nach fünfzig Wochen hatten sich in zwei von fünf Experimentansätzen dauerhafte und klumpige Verbände mit vielen Chlamydomonas-Zellen formiert.[106] Die Neigung zur Bildung solcher Zellverbände ist vererbbar.[107] Sie nehmen ein größeres Volumen ein und erschweren es somit ihren Fressfeinden, festgehalten und verdaut zu werden.[108]
Choanocyten zuerst
Zwei Hypothesen sehen den Beginn der vielzelligen Tiere in Kolonien aus Kragengeißelzellen. Nach diesen Hypothesen hätten die sessilen Organismen extrem einfach gebauten Abschnitten der Wandungen heutiger Schwämme geähnelt.[77] Tatsächlich wird heutzutage vielfach davon ausgegangen, dass die Urmetazoa zu den Schwämmen gehörten.[60][61]
Nach der ersten Hypothese hätten die fest miteinander verbundenen Zellen eine einzellige Schicht gebildet. Die Zellschicht hätte sich wie die Haut einer Blase um einen flüssigkeitsgefüllten Hohlraum gelegt, dem ersten Mesohyl. Vermutlich hätte die Zellkolonie einem festen Untergrund aufgesessen. Die Verbindung zwischen Zellkolonie und Untergrund hätte die Evolution eines neuen Zelltyps aus spezialisierten Haltezellen forciert haben können, den ersten Pinacocyten. Zusammengenommen hätten solche Organismen einerseits mit Choanocyten und Pinacocyten zwei Zelltypen besessen und andererseits in sich jeweils ein zentrales Mesohyl geborgen.[77]

Gemäß der zweiten und etwas älteren Hypothese begann der Weg zur Vielzelligkeit nicht mit einer sessilen, sondern mit einer kugelförmigen planktischen Zellkolonie aus Stammgruppen-Choanoflagellaten. Die Zellen hätten sich lückenlos einander gelagert. Auf diese Weise hätten sie einen zentralen, flüssigkeitsgefüllten Hohlraum umfasst (ähnlich wie bei Barroeca monosierra). Dieses Stadium der Hohlkugel wird „Choanoblastaea“ genannt. Anschließend wären Zellen aus der Hülle in den zentralen Hohlraum gewandert und zu anderen Zelltypen differenziert. Es hätte sich die „fortgeschrittene Choanoblastaea“ gebildet, eine mit unterschiedlichen Zelltypen ausgefüllte Zellkolonie. Die Zellkolonie hätte sich daraufhin auf den Untergrund gesetzt und wäre sessil geworden.[78][109]
Die zwei vorgestellten Hypothesen fordern ein Duo entscheidender Schritte für die Evolution von Kragengeißeltierchen zu frühen Schwämmen. Erstens entwickelte sich eine dauerhafte Mehr- bis Vielzelligkeit, die zweitens unterschiedlich differenzierte Zelltypen umfasste. Für beide Schritte wurden Entsprechungen bei heutigen Kragengeißeltierchen entdeckt. Individuen der Art Salpingoeca rosetta aus der Ordnung der Craspedida können zu fünf klar unterscheidbaren Kragengeißelzelltypen (Morphotypen) differenzieren.[110][111] Es wird auch ein Kragengeißelzelltyp gebildet, der mehr- bis vielzellige und rosettenförmige Zellkolonien ausformt.[112] Der Reiz für die Differenzierung zum Kragengeißelzelltyp der Rosetten-Kolonien besteht aus dem Stoff rosette inducing factor (RIF-1). Bei RIF-1 handelt es sich um ein Sulfonolipid.[113] Es wird von Bakterien der Gattung Algoriphagus sowie nahe verwandten Organismen aus dem Bakterienstamm der Bacteroidetes produziert und möglicherweise ins Wasser abgegeben.[114] Die Bakterien dienen Salpingoeca rosetta als Nahrung. Wahrscheinlich können die Rosetten-Kolonien ein Bakterienvorkommen effektiver verzehren, als dies einer einzelnen Kragengeißelzelle möglich wäre.[115] Von außen betrachtet scheint die Rosetten-Kolonie eine Ähnlichkeit zum embryonalen Morula-Stadium der Tiere zu besitzen.[116] Die Zellen stehen untereinander in Verbindung mit Filopodien[117] und mit Zellplasma-gefüllten Membranschläuchen (Plasmabrücken).[118] Die Plasmabrücken werden durchschnittlich einen dreiviertel Mikrometer lang und verbinden die Zellen der Kolonie in einem unregelmäßigen Netzwerk.[119] Sie könnten zur zeitweiligen Kommunikation zwischen den Zellen dienen.[120] Alternativ könnten die Plasmabrücken auch einfach bestehen bleibende Verbindungen zwischen zwei Tochterzellen darstellen, die aus einer gemeinsamen Zellteilung hervorgegangen sind.[120] Die Zellen der Rosetten-Kolonien besitzen einige Ähnlichkeiten zu amöboiden Zellen.[121] So stülpen sie um die acht Scheinfüßchen aus,[122] ihre Zellleiber zeigen gelegentlich unregelmäßige Vorwölbungen[123] und jede Zelle birgt in ihrem Zellleib etwa fünf Makropinosomen.[122] Die Zellen einer Kolonie unterscheiden sich untereinander auffällig in der Größe,[124] die Volumina ihrer Zellleiber schwanken ungefähr zwischen zehn und vierzig Kubikmikrometern.[125] Außerdem können innerhalb der Rosetten-Kolonien zwei besondere längliche Zelltypen gefunden werden, deren Zellleiber an Karotten und an Chili-Schoten erinnern.[126] Vielleicht können derlei Unterschiede in den Zellgestalten als Ansätze von Zelldifferenzierungen interpretiert werden.[127] Der durchschnittliche Durchmesser einer Rosetten-Kolonie von Salpingoeca rosetta beträgt zehn Mikrometer. Ausnahmen können bis zu dreißig Mikrometer erreichen. Demhingegen besitzen die viel größeren Rosetten-Kolonien der nahe verwandten Art Barroeca monosierra mittlere Durchmesser von fünfundzwanzig Mikrometern. Ein paar Exemplare können sogar auf bis zu einhundertzwanzig Mikrometer anwachsen.[128]
Archaeocyten zuerst
Einzelne Kragengeißelzellen der Art Salpingoeca rosetta können ihre äußere Zellgestalt grundlegend verändern (Transdifferenzierung).[129] Die Gestaltveränderung erfolgt auf reversible Weise, sie kann also auch wieder rückgängig gemacht werden.[130] Meistens innerhalb weniger Minuten werden die Kränze aus Stereovilli und die Geißeln in die Zellleiber zurückgezogen und abgebaut. Die Zellen verlieren ihre rundlichen Gestalten. Sie wandeln sich zu amöboiden Zellen.[129] Die Umwandlungen finden statt, wenn die Kragengeißeltierchen räumlich stark beengt werden.[131] Ihre zweite Gestalt befähigt sie zu amöboiden Bewegungen, mit denen sie aus den Beengungen kriechen können.[132] Transdifferenzierungen zu amöboiden Zellen wurden noch an fünf weiteren Kragengeißeltierchen-Arten beobachtet.[133]
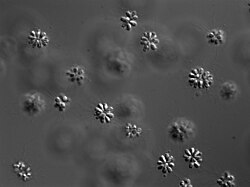
Auf der einen Seite differenzieren rezente Choanoflagellaten zu wenigen unterschiedlichen Kragengeißelzelltypen.[110] Die Kragengeißelzellen transdifferenzieren zu amöboiden Zellen. Die amöboiden Zellen transdifferenzieren wieder zu Kragengeißelzellen.[130] Auf der anderen Seite besitzen heutige Schwämme wenige unterschiedliche Schwammzelltypen. Zu den Schwammzelltypen gehören die amöboiden Archaeocyten. Die Archaeocyten differenzieren zu den übrigen Schwammzelltypen. Zu den übrigen Schwammzelltypen gehören auch Kragengeißelzellen. Diese Kragengeißelzellen transdifferenzieren wieder zu Archaeocyten.[134] Das Muster der exprimierten Gene in den Archaeocyten der Schwämme ähnelt sehr jenem Muster, das in den Kragengeißelzellen der Kragengeißeltierchen vorliegt. Andererseits unterscheiden sich die Genexpressionsmuster von Kragengeißeltierchen-Kragengeißelzellen und Schwamm-Kragengeißelzellen in viel stärkerem Maße voneinander.[135]
Die Beobachtungen zu den Transdifferenzierungen führten zu einer weiteren Hypothese bezüglich der Urmetazoa: Sie hätten nicht als Kragengeißelzellkolonien begonnen. Stattdessen wären ihre Körper aus Verbänden eines Zelltyps aufgebaut gewesen, der sich in weitere Zelltypen transdifferenzieren konnte – wie es in ähnlicher Weise heute anhand der Archaeocyten nachvollzogen werden kann.[136] Als einer jener weiteren Zelltypen hätten sich dann wieder Kragengeißelzellen etabliert.[137] Aus dieser Hypothese würde allerdings auch folgen, dass die Kragengeißelzellen der Choanoflagellata und die Choanozyten der Schwämme miteinander nicht direkt homolog wären.[138]
Frühe Fossilien
Ein Mangel an Fossilien erschwert die Rekonstruktion der Stammesgeschichte der Choanozoa für hunderte Millionen Jahre.[139] Zwar wurde eine Reihe möglicher Tier-Fossilien beschrieben, aber keiner dieser vermeintlichen Schwämme konnte allgemein überzeugen.[140] Als erste weniger umstrittene Belege der Choanozoa erweisen sich Versteinerungen von Schwämmen und anderen Tieren, die aus den letzten Jahrmillionen kurz vor Anbruch des Phanerozoikums kommen.[141]
Tonium

Gelb: Pinacocyten.
Rot: Choanocyten.
Grau: Mesohyl.
Blauer Pfeil: Wasserausstrom durch das Osculum.
Im Gegensatz zu jenen hypothetischen Urmetazoa besitzen voll entwickelte Schwämme komplexere Baupläne. Sie verfügen über ein paar Zelltypen mehr. Ihre Körper erreichen makroskopische Ausmaße und werden häufig (wenn auch nicht immer) gestützt von einem Gerüst aus harten Skelettnadeln, den Schwammspicula.[142] In ihren dünnen Außenwänden befinden sich kleine Poren, die Ostia. Durch sie strömt Wasser ein. Es gelangt danach in den kelchartigen, zentralen Suboscularraum und wird anschließend durch das mittig oben gelegene Osculum wieder ausgestoßen.[143] Möglicherweise könnten Reste einer frühen Form dieses Bauplans fossil erhalten geblieben sein. Die ältesten stammen aus der Erdzeitperiode des Toniums.
Vermiforme Mikrostrukturen
In der Stone-Knife-Formation (Nordwest-Kanada) wurden fossile Stromatolithen gefunden, die von Cyanobakterien aufgebaut worden waren. Das Alter dieser Flachwasserstrukturen wurde auf ungefähr 890 Millionen Jahre datiert.[144] Unmittelbar auf und neben den Stromatolithen und an ihren Seiten wurden sogenannte vermiforme Mikrostrukturen entdeckt. Es handelt sich um kalkige Spuren von unregelmäßigen Netzen aus winzigen Röhren, die jeweils einige Millimeter bis wenige Zentimeter Länge erreichten. Die vermiformen Mikrostrukturen wurden möglicherweise von keratosen („hornigen“) Hornkieselschwämmen (Demospongiae) hinterlassen. Es waren Schwämme, die kein stützendes Gerüst aus harten Schwammspicula aufbauten, sondern einzig aus dem Strukturprotein Spongin.[144] Keratose Hornkieselschwämme kommen noch in heutigen Meeren vor, auch wenn sie erheblich größere Körpermaße erreichen. Der gewöhnliche Badeschwamm (Spongia officinalis) gehört zu ihnen.[145] Vermutlich beschränkte sich das Areal jener sehr frühen Schwämme auf das flache Wasser in größter Nähe zu den Stromatolithen, weil dort die Cyanobakterien durch ihre oxygene (Sauerstoff-freisetzende) Photosynthese überlebenswichtiges Sauerstoffgas (O2) bereitstellten. Während alle anderen Zonen der Meere noch so gut wie sauerstofffrei waren, konnten die Schwämme mit den hiesigen, wenn auch immer noch sehr geringen Sauerstoffkonzentrationen überleben.[146] Vermutlich nutzten diese Tiere bereits einen Hämocyanin-Farbstoff, um den Sauerstoff besser zwischen ihren Zellen zu verteilen.[147]
Otavia
Noch weitere Frühformen des Schwamm-Bauplans könnten fossil erhalten geblieben sein und besitzen ein Alter von knapp 760 Millionen Jahren. Sie wurden in marinen Flachwasser-Sedimentgesteinen Namibias gefunden[148] und erhielten den Gattungsnamen Otavia. Die winzigen Fossilien wurden höchstens fünf Millimeter lang und besitzen entfernt ei- oder kugelförmige Gestalt. Ihre dünnen Wände sind durch viele winzige Öffnungen durchlöchert, die als Ostia interpretiert wurden. Dazu treten mehrere größere Aussparungen, die als Oscula angesehen werden könnten.[149] Insgesamt jedoch scheint es nicht unbedingt naheliegend, Otavia als frühen Schwamm zu deuten. Vielleicht handelt es sich bloß um Körner aus Calciumphosphat, die von Sand aufgeraut, durchlöchert und ausgehöhlt worden sind.[150]
Cryogenium
Während der Existenzphase von Otavia[149] wechselte die Erde in die Periode des Cryogeniums. Vor rund 717 Millionen Jahren setzte die Sturtische Eiszeit ein, die in wenigen tausend bis einigen zehntausend Jahren den Planeten fast vollständig mit Eis überzog.[151] Sie dauerte um die 58 Millionen Jahre und endete vor ungefähr 659 Millionen Jahren.[152] Etwa 13 Millionen Jahre später folgte nochmals die Marinoische Eiszeit, die für 10 Millionen weitere Jahre in ähnlicher Weise fast die gesamte Erde unter Eis verschwinden ließ.[153] Die Schwämme mussten sich an die extremen Umweltbedingungen anpassen. Zwar hatte sich kurz vor Beginn der Cryogeniums in den Ozeanen eine dünne oberflächennahe Schicht mit leicht oxygeniertem Wasser etabliert, in der also etwas Sauerstoff gelöst war.[154] Doch im Dunkel unter den mächtigen geschlossenen Eisdecken verbrauchten die Organismen schnell das spärliche Gas, so dass bald größte Sauerstoffarmut herrschte.[155] Vielleicht überlebten die Schwämme am unteren Ende von Gletscherspalten, die bis zum Meerwasser hinabreichten, oder sie beschränkten ihre Areale auf jene kleinräumigen Zonen in Äquatornähe,[155] die möglicherweise eisfrei blieben.[156] Zum Zeitpunkt des Einsetzens der Sturtischen Eiszeit war der atmosphärische Sauerstoffgehalt nämlich schon auf etwa 1 % des heutigen Werts gestiegen[157] und überall dort, wo die Luft mit dem Meerwasser in Verbindung trat, hätte sich Sauerstoffgas in den Wassern lösen können.

Weiterhin aber verwitterten die Gesteine von jenen Vulkanen und Gebirgen, die das Eis durchstießen. Es entstanden Stäube, die von Winden erfasst und auf den Oberseiten der Gletscher abgelagert wurden. Solche mineralischen Stäube waren reich an Nährsalzen. Die Salze wurden in Flüssigwasser gelöst, wenn sich im Sommer flache Schmelzwasserseen auf den Gletschern bildeten. Wahrscheinlich gediehen vor allem Cyanobakterien in diesen flachen und nährsalzreichen Gewässern. Die Bakterien betrieben oxygene Photosynthese, wenn genügend Sonnenlicht durch die staubreiche Luft zu ihnen drang.[158] Die oxygene Photosynthese reicherte die erdnahe Luft weiter mit Sauerstoffgas an,[159] so dass gegen Ende der Sturtischen Eiszeit die Luftsauerstoff-Konzentration möglicherweise etwas mehr als ein Hundertstel ihres heutigen Werts betrug.[160] Ein Anteil des Sauerstoffs gelangte auch unter das Eis ins Meer: Die Stellen, an denen sich Schelfeis vom Meeresboden abhebt und auf dem Wasser zu schwimmen beginnt, heißen Aufsetzlinien. Auch während der Eiszeiten des Cryogeniums traten an den Aufsetzlinien wahrscheinlich Schmelzwässer von den Unterseiten der Gletscher aus. In solchen subglazialen Schmelzwässern befand sich etwas Sauerstoff. Der Sauerstoff stammte aus Luftblasen, die vormals im Gletschereis eingeschlossen worden waren und nun in den aufgeschmolzenen Wässern gelöst wurden. Die subglazialen Schmelzwässer vermischten sich an den Aufsetzlinien mit dem Meerwasser. Somit wurde es mit Sauerstoff angereichert. Mit Hilfe dieser Schmelzwasser-Sauerstoff-Pumpe entstanden unter dem schwimmenden Eis vor den Aufsetzlinien leicht oxygenierte Wasserkörper. Auf Streifen von wenigen hundert Metern Breite hätten sich Schwämme und andere benthische aerobe Organismen ansiedeln können. Jenseits davon griffen oxygenierte Wasserschwaden hinaus, die sich zunehmend in Richtung Eisdeckenunterseite verjüngten, bis sie ungefähr zweitausend Meter vor den Aufsetzlinien endeten. In diesen Wasserschwaden hätten pelagische aerobe Lebensformen überleben können.[161]
Überleben im Cryogenium
Die Umwelt des Cryogeniums wirkte mit sehr harschen abiotischen Selektionsfaktoren auf die Schwämme. Ein gewisser Teil der damals evolvierten Überlebensfähigkeit könnte bis heute weiter vererbt worden sein. Rezent bilden die Dauerstadien (Gemmulae) des Süßwasserschwamms Ephydatia muelleri selbst dann neue Schwammkörper, wenn sie 112 Tage unter sauerstofffreien (anoxischen) Bedingungen aufbewahrt worden sind.[162] Der kriechende Meeresschwamm Tethya wilhelma vollführt seine regelmäßigen Ganzkörper-Kontraktionen mit üblichen Wiederholungsraten noch bei 4 % der heutigen atmosphären Sauerstoffkonzentration.[163] Auch bei 0,25 % ändert er nicht die Ableseraten seiner Gene.[164] Weiterhin überstehen mehr als 80 % der Gemmulae des Süßwasserschwamms Eunapius fragilis eine einstündige Abkühlung auf −70 °C.[165] Darüber hinaus wurde im Jahr 2016 auf dem antarktischen Filchner-Ronne-Schelfeis ein Loch durch 872 Meter dickes Eis gebohrt. An der Bohrstelle ragte die Oberseite des Schelfeises 111 Meter über den Meeresspiegel. Mit Hilfe einer Tauchkamera wurden die darunter liegenden 472 Meter freier Wassersäule überwunden und der Meeresgrund erreicht. Dort wuchsen an den Seiten eines Felsblocks ein gestielter Schwamm und fünfzehn ungestielte Schwämme, alle von jeweils einigen Zentimetern Größe. Die Schwämme lebten in völliger Dunkelheit in einer Meerestiefe von insgesamt 1.233 Metern (1.344 Meter unter der Schelfeisoberfläche) sowie in einer Entfernung von 260 Kilometern vom Schelfeisrand und bei einer Wassertemperatur von −2,2 °C.[166]
Steroid-Biomarker
Die ältesten chemischen Fossilien von Schwämmen könnten aus einem jüngeren Abschnitt des Cryogeniums stammen. Sie könnten in zwei Biomarkern aus der Gruppe der Steroide gesehen werden, die 24-Isopropylcholestan und 26-Methylstigmastan heißen. Die Moleküle wurden in Gesteinen und Erdöl aus Oman gefunden. Heute werden sie ausschließlich von Schwämmen produziert. Die Biomarker könnten darauf hindeuten, dass Schwämme vor mindestens 635 Millionen Jahren tatsächlich existierten.[167][168] Jedoch könnten die Stoffe auch von anderen Organismen herrühren. Einzeller aus der Gruppe der Rhizarien stellen Vorgänger beider Moleküle her,[169] gleiches gilt für Grünalgen. Die Vorgängermoleküle hätten anschließend durch geochemische Prozesse verändert werden können, so dass sie heute als 24-Isopropylcholestan und 26-Methylstigmastan vorliegen.[170][171]
Ediacarium

Wahrscheinlich ragten während des gesamten Cryogeniums Vulkane durch die Eisdecken. Sie reicherten die Erdatmosphäre über mehrere Jahrmillionen allmählich mit Kohlendioxid an. Das Gas erreichte das Mehrhundertfache seiner heutigen atmosphärischen Konzentration und steigerte den natürlichen Treibhauseffekt beträchtlich. Auf diese Weise wurden schließlich die Vereisungen beendet. Die Erde ging in eine ausgeprägte Warmphase über. Das Eis schmolz, der erdweite Meeresspiegel stieg um bis zu 500 Meter.[172] Es begann die Erdzeitperiode des Ediacariums.
Weng'an Biota
Die sehr feinkörnigen Phosphoriten der Doushantuo-Formation (Südwest-China) enthalten die Weng'an Biota. Die Mikrofossilien besitzen wahrscheinlich ein Alter von etwas mehr als 609 Millionen Jahren[173] und wurden als Eier oder frühe Embryonen von Tieren interpretiert. Allerdings könnten sie genauso Überreste von Algenzysten darstellen[174] oder auch von sehr großen Schwefelbakterien stammen, die der rezenten Gattung Thiomargarita ähnelten.[175] Dennoch scheinen zumindest die Weng'an-Biota-Fossilien der Gattungen Tianzhushania,[176] Spiralicellula und Megasphaera größere Ähnlichkeiten mit frühen Tierembryonen zu besitzen.[177] Die Kriterien, mit denen die drei Gattungen zu Tierembryonen erklärt worden waren, wurden trotzdem als nicht stichhaltig zurückgewiesen.[178] Andererseits scheinen bei Megasphaera sogar mehrere Stadien unterscheidbar zu sein, die an Vorgänge während der frühen embryonalen Entwicklung von Tieren erinnern.[179][180] Ähnliches gilt für die Mikrofossilien der Gattungen Caveasphaera,[181] Helicoforamina[182] und Ostiosphaera.[183]
Eocyathispongia
Aus den Gesteinen der Doushantuo-Formation könnten weitere Spuren früher Schwämme geborgen worden sein. Dort wurde in 600 Millionen Jahre alten marinen Flachwasser-Sedimentgesteinen ein einziges und winziges Exemplar der Gattung Eocyathispongia gefunden. Das Fossil besitzt ein Volumen von etwa drei Kubikmillimetern und zeigt eine knotenhaft-kugelförmige Gestalt. Sein Inneres besteht aus drei Kammern, die jeweils durch eine Öffnung mit dem umgebenden Wasser verbunden waren. Die Öffnungen wurden als Oscula gedeutet. Eocyathispongia bestand aus hunderttausenden Zellen. Die Wände der drei Kammern waren aus mehreren Zellschichten aufgebaut.[184] Im Inneren des Fossils wurden Felder aus hunderten dicht aneinandergereihter, winziger topfartiger Waben entdeckt. Dort könnten möglicherweise Choanocyten aufgereiht gewesen sein. Von diesen Zellen fehlt ansonsten aber jede Spur.[185] Die Schwamm-Zugehörigkeit des Fossils kann auf mehreren Wegen bezweifelt werden. Das Fossil besitzt weder Ostia noch Schwammspicula. Es ähnelt auch in seiner äußeren Gestalt keinem sonst bekannten Schwamm.[186] Außerdem könnten die inneren Oberflächen von Eocyathispongia zu klein für die Ernährung des Gesamtorganismus gewesen sein. Die dort vermeintlich sitzenden Choanocyten hätten vielleicht nicht genügend Nahrungspartikel abfiltrieren können, um sämtliche Zellen des Körpers ausreichend zu versorgen.[187]
Schwammspicula
Darüber hinaus könnten in der Doushantuo-Formation noch fossile Schwammspicula liegen. Das Alter ihres Fundorts wird auf 580 Millionen Jahre geschätzt.[188] Auch hier ist umstritten, ob es sich wirklich um Überreste von Schwämmen handelt.[189] Die fossilen Partikel könnten ebenso fossile Fragmente von Strahlentierchen (Radiolaria) darstellen.[190] Möglicherweise haben die verschiedenen Linien der Schwämme erst vierzig Millionen Jahre später und unabhängig voneinander begonnen, härtende Biomineralisationen ihrer Spicula zu evolvieren.[191][192]
Helicolocellus
Aus einer etwa 550 Millionen Jahre alten Gesteinsschicht der Dengying-Formation (Süd-China) ist ein Fossil bekannt geworden, das den Namen Helicolocellus cantori bekam. Das sessil lebende und rund 40 Zentimeter hohe Tier ähnelte auffällig einem Glasschwamm (Hexactinellida), besaß aber noch kein Skelett aus Hartteilen. Helicolocellus könnte als bisher ältester Beleg für das unzweifelhafte Vorhandensein von Schwämmen gelten.[193]
Tabulata und Haootia
Gemäß der molekularen Uhr könnten schon vor etwa 920 Millionen Jahren[79] aus der Stammgruppe der Schwämme die übrigen Tiere hervorgegangen sein.[194][195][61] Vielleicht besaß der letzte gemeinsame Vorfahre aller übrigen Tiere ein scheibenförmiges Aussehen („Placula“)[196] oder er ähnelte einer Hohlkugel („Gastraea“).[197][198] In beiden Fällen soll dieser winzige Organismus aus zwei Zellschichten bestanden haben. Außerdem verschwand in dieser neuen Entwicklungslinie der Zelltyp der Kragengeißelzellen. Zur Weng'an Biota gehören auch eine Reihe feiner fossiler Röhren, die als Spuren einer Gruppe der übrigen Tiere gedeutet wurden. Sie sollten von Nesseltieren aus der Klasse der Blumentiere (Anthozoa) herrühren, nämlich aus der ausgestorbenen Gruppe der Tabulata.[199] Jedoch könnten die Röhren ebenso zum Beispiel von Algenfäden hinterlassen worden sein.[200]
Im unteren Abschnitt der Gesteine der Fermeuse-Formation (Neufundland) wurde das Fossil Haootia quadriformis gefunden. Sein Alter wird auf ungefähr 560 Millionen Jahre geschätzt. Der Abdruck dieser wahrscheinlich sessilen Lebensform weist feine Linienmuster auf, die wie gebündelte Gewebebündel aussehen und stark an Muskelfasern erinnern. Möglicherweise glich Haootia in seinem Körperbau heutigen Stielquallen (Staurozoa). Demzufolge könnte jene Lebensform zu den Nesseltieren gehört haben.[201]
Dickinsonia und Andere

Südaustralische Gesteine mit einem Alter zwischen 571 und 539 Millionen Jahren enthalten Abdrücke einer winzigen und gedrungen wurmförmigen Lebensform, die möglicherweise zu den Tieren gehörte, genauer gesagt zu den Zweiseitentieren (Bilateria). Sie erhielt den Gattungsnamen Ikaria.[202] Aus dem gleichen zeitlichen Horizont stammen die vermutlichen Zweiseitentiere Spriggina[203][204] und Kimberella[205] mit etwa 555 Millionen Jahren,[206] sowie die mögliche Stammgruppen-Rippenqualle (Ctenophora) Eoandromeda mit 551 Millionen Jahren.[207] Ähnliche Alter besitzen der wahrscheinlich röhrenbewohnende Wurm Cloudina[208] und der segmentierte Wurm Yilingia.[209] Dazu tritt noch ein mögliches Lophotrochozoon namens Namacalathus aus 547 Millionen Jahre alten namibischen Gesteinen.[210] Auch andere Vertreter dieser Ediacara-Fauna wurden verschiedentlich als Tiere vorgeschlagen, wie zum Beispiel die Gattung Dickinsonia.[62] Dass letztere ein Tier war, könnte durch bestimmte Steroide belegt worden sein. Die Moleküle wurden im Fossil gefunden und gelten in der Regel als Biomarker für Tiere.[141][211] Möglicherweise stellte Dickinsonia eine Gattung besonders großer Plattentiere (Placozoa) dar.[212]
Kambrium
Das Ediacarium neigte sich dem Ende entgegen. Auf der Südhalbkugel verbanden sich Landmassen zum Großkontinent Gondwana. Die Berge des Transgondwanan Supermountain wurden angehoben,[213] einer Bergkette von mehr als achttausend Kilometern Länge und gemeinhin mehr als eintausend Kilometern Breite.[214] Zudem brachen viele Vulkane aus. Sie reicherten den Erdatmosphäre mit dem Treibhausgas Kohlendioxid an. Die globale Durchschnittstemperatur stieg.[215] Die Ozeane durchliefen eine Phase großer Sauerstoffarmut,[216] der 80 % der Ediacara-Fauna zum Opfer fielen.[217] Doch unter den wärmeren Klimabedingungen beschleunigte sich die Verwitterung der subaerischen Gesteinsmassen, die gerade wegen des Supergebirges in sehr großem Umfang vorhanden waren. Die Minerale der Gesteine wurden von Gewässern gelöst und gelangten ins Meer. Dort wirkten sie als Dünger des Algenwachstums. Die somit vermehrte oxygene Photosynthese war wahrscheinlich hauptverantwortlich für den Anstieg des Sauerstoffgehalts.[215] Zudem könnte eine außergewöhnliche Schwäche des Erdmagnetfelds ebenfalls dazu beigetragen haben.[218] Vor 541 Millionen Jahren wechselte dann die Erde in die Erdzeitperiode des Kambriums. Vermutlich erwies sich der erhöhte Sauerstoffgehalt als einer der Hauptgründe für die nun einsetzende kambrische Explosion.[219] Die Tiere bildeten fortan Hartsubstanzen in ihren Stützgeweben und für Schalen und Gehäuse.[220] Dadurch begünstigten sie ihre Fossilisation. Deshalb sind Fossilien der Choanozoa seit dem Kambrium in großer Menge und Vielfalt vorhanden.[221] Auch die ersten unbestrittenen Schwammspicula lagerten sich während des Übergangs zum Kambrium ab.[192]
Literatur
- Jonathan B. Antcliffe, Richard H. T. Callow, Martin D. Brasier: Giving the early fossil record of sponges a squeeze. In: Biological Reviews. Band 89, 2014, doi:10.1111/brv.12090, S. 972–1004.
- Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440.
- Thomas Cavalier-Smith: Origin of animal multicellularity: precursors, causes, consequences — the choanoflagellate/sponge transition, neurogenesis and the Cambrian explosion. In: Philosophical Transactions of the Royal Society B. Band 372, 2017, doi:10.1098/rstb.2015.0476, Artikel Nr. 20150476.
- Xingliang Zhang, Degan Shu: Current understanding on the Cambrian Explosion: questions and answers. In: Paläontologische Zeitschrift. Band 95, 2021, doi:10.1007/s12542-021-00568-5, S. 641–660.
Einzelnachweise
- ↑ John Ellis: On the nature and formation of sponges. In: Philosophical Transactions of the Royal Society of London. Band 55, 1765, doi:10.1098/rstl.1765.0032, S. 283–284.
- ↑ a b Libbie Henrietta Hyman: Protozoa through Ctenophora (= McGraw-Hill publications in the zoological sciences. Band 1: Invertebrates.). McGraw-Hill Book Company, New York / London 1940, ISBN 0-07-031660-0, S. 284.
- ↑ Christian Gottfried Ehrenberg: Über die Entwicklung und Lebensdauer der Infusorien. In: Abhandlungen der Königlichen Akademie der Wissenschaften zu Berlin. Aus dem Jahre 1831. Berlin 1832, S. 95 (Digitalisat).
- ↑ Raoul Heinrich Francé: Der Organismus der Craspedomonaden. Budapest 1897, S. 118 (Digitalisat).
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 1.
- ↑ Georg Fresenius: Beiträge zur Kenntniss mikroskopischer Organismen. In: Abhandlungen der Senckenbergischen naturforschenden Gesellschaft. Band 2, 1858, S. 233, 242, Tafel X (Digitalisat).
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 2.
- ↑ Raoul Heinrich Francé: Der Organismus der Craspedomonaden. Budapest 1897, S. 121 (Digitalisat).
- ↑ Félix Dujardin: Histoire naturelle des zoophytes. Librairie encyclopédique de Roret, Paris 1841, S. 306 (Digitalisat).
- ↑ Henry James-Clark: On the Spongiae Ciliatae as Infusoria Flagellata. In: Memoirs read before the Boston Society of Natural History. Band 1, 1867, S. 305–340 (Digitalisat).
- ↑ Thomas Henry Huxley: On the Classification of the Animal Kingdom. In: The American Naturalist. Band 09, 1875, S. 67 (Digitalisat).
- ↑ vgl. Gert Wörheide, Martin Dohrmann, Dirk Erpenbeck, Claire Larroux, Manuel Maldonado, Oliver Voigt, Carole Borchiellini, Dennis V. Lavrov: Deep Phylogeny and Evolution of Sponges (Phylum Porifera) . In: Advances in Marine Biology. Band 61, 2012, doi:10.1016/B978-0-12-387787-1.00007-6, S. 1.
- ↑ a b Patricia O. Wainright, Gregory Hinkle, Mitchell L. Sogin, Shawn K. Stickel: Monophyletic origins of the Metazoa: An evolutionary link with fungi. In: Science. Band 260, 1993, doi:10.1126/science.8469985, S. 340.
- ↑ a b Thomas Cavalier-Smith, Ema E-Y. Chao: Phylogeny of choanozoa, apusozoa, and other protozoa and early eukaryote megaevolution. In: Journal of Molecular Evolution. Band 56, 2003, doi:10.1007/s00239-002-2424-z, S. 540.
- ↑ a b Emma Steenkamp, Jane Wright, Sandra Baldauf: The Protistan Origins of Animals and Fungi. In: Molecular Biology and Evolution. Band 23, 2006, doi:10.1093/molbev/msj011, S. 99.
- ↑ Jean-Luc Da Lage, Etienne G. J. Danchin, Didier Casane: Where do animal α-amylases come from? An interkingdom trip. In: Federation of European Biochemical Societies Letters. Band 581, 2007, doi:10.1016/j.febslet.2007.07.019, S. 3931–3932.
- ↑ Ulrich Kutschera: Evolutionsbiologie. Verlag Eugen Ulmer, Stuttgart 2015, ISBN 978-3825286231, S. 185 (Digitalisat).
- ↑ Stephen R. Fairclough, Zehua Chen, Eric Kramer, Qiandong Zeng, Sarah Young, Hugh M. Robertson, Emina Begovic, Daniel J. Richter, Carsten Russ, M. Jody Westbrook, Gerard Manning, B. Franz Lang, Brian J. Haas, Chad Nusbaum, Nicole King: Premetazoan genome evolution and the regulation of cell differentiation in the choanoflagellate Salpingoeca rosetta. In: Genome Biology. Band 14, 2013, R 15, doi:10.1186/gb-2013-14-2-r15, S. 4.
- ↑ Graham E. Budd, and Sören Jensen: The origin of the animals and a ‘Savannah’ hypothesis for early bilaterian evolution. In: Biological Reviews. Band 92, 2017, doi:10.1111/brv.12239, S. 448.
- ↑ a b Thibaut Brunet, Nicole King: The Origin of Animal Multicellularity and Cell Differentiation. In: Developmental Cell. Band 43, 2017, doi:10.1016/j.devcel.2017.09.016, S. 127.
- ↑ Hervé Philippe, Romain Derelle, Philippe Lopez, Kerstin Pick, Carole Borchiellini, Nicole Boury-Esnault, Jean Vacelet, Emmanuelle Renard, Evelyn Houliston, Eric Quéinnec, Corinne Da Silva, Patrick Wincker, Hervé Le Guyader, Sally Leys, Daniel J. Jackson, Fabian Schreiber, Dirk Erpenbeck, Burkhard Morgenstern, Gert Wörheide, Michael Manuel: Phylogenomics Revives Traditional Views on Deep Animal Relationships. In: Current Biology. Band 19, 2009, doi:10.1016/j.cub.2009.02.052, S. 709.
- ↑ Thomas Cavalier-Smith: Kingdom Protozoa and Its 18 Phyla. In: Microbiological Reviews. Band 57, 1993, doi:10.1128/MMBR.57.4.953-994.1993, S. 971.
- ↑ Kamran Shalchian-Tabrizi, Marianne A. Minge, Mari Espelund, Russell Orr, Torgeir Ruden, Kjetill S. Jakobsen, Thomas Cavalier-Smith: Multigene Phylogeny of Choanozoa and the Origin of Animals. In: PLOS One. Band 3, 2008, e2098, doi:10.1371/journal.pone.0002098, S. 2.
- ↑ Sina M. Adl, David Bass, Christopher E. Lane, Julius Lukes, Conrad L. Schoch, Alexey Smirnov, Sabine Agatha, Cedric Berney, Matthew W. Brown, Fabien Burki, Paco Cárdenas, Ivan Cepicka, Lyudmila Chistyakova, Javier del Campo, Micah Dunthorn, Bente Edvardsen, Yana Eglit, Laure Guillou, Vladimír Hampl, Aaron A. Heiss, Mona Hoppenrath, Timothy Y. James, Anna Karnkowska, Sergey Karpov, Eunsoo Kim, Martin Kolisko, Alexander Kudryavtsev, Daniel J.G. Lahr, Enrique Lara, Line Le Gall, Denis H. Lynn, David G. Mann, Ramon Massana, Edward A.D. Mitchell, Christine Morrow, Jong Soo Park, Jan W. Pawlowski, Martha J. Powell, Daniel J. Richter, Sonja Rueckert, Lora Shadwick, Satoshi Shimano, Frederick W. Spiegel, Guifré Torruella, Noha Youssef, Vasily Zlatogursky, Qianqian Zhang: Revisions to the Classification, Nomenclature, and Diversity of Eukaryotes. In: Journal of Eukaryotic Microbiology. Band 66, 2019, doi:10.1111/jeu.12691, S. 20.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 10.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press 2015, ISBN 978-0521884440, S. 25, 28.
- ↑ Sally P. Leys, Dafne I. Eerkes-Medrano: Feeding in a Calcareous Sponge: Particle Uptake by Pseudopodia. In: Biology Bulletin. Band 211, 2006, S. 157.
- ↑ Neil A. Campbell, Jane B. Reece: Biologie. Heidelberg/Berlin 2006, ISBN 3827371805, S. 769.
- ↑ a b Stephen R. Fairclough, Mark J. Dayel, Nicole King: Multicellular development in a choanoflagellate. In: Current Biology. Band 20, 2010, doi:10.1016/j.cub.2010.09.014, S. R875.
- ↑ Gonzalo Giribet, Gregory D. Edgecombe: The Invertebrate Tree of Life. Princeton University Press, Princeton/Oxford 2020, ISBN 978-0691170251, S. 36–37.
- ↑ a b c Thibaut Brunet, Nicole King: The Origin of Animal Multicellularity and Cell Differentiation. In: Developmental Cell. Band 43, 2017, doi:10.1016/j.devcel.2017.09.016, S. 125.
- ↑ a b c d e f g h Thomas Cavalier-Smith: Origin of animal multicellularity: precursors, causes, consequences — the choanoflagellate/sponge transition, neurogenesis and the Cambrian explosion. In: Philosophical Transactions of the Royal Society B. Band 372, 2017, doi:10.1098/rstb.2015.0476, Artikel Nr. 20150476, S. 2.
- ↑ Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 10, 12–13 sowie S. 9, Abb. 4F im Vergleich zu S. 9, Abb. 4G und weiterhin S. 9, Abb. 4B im Vergleich zu S. 6, Abb. 2A und 2B.
- ↑ Jasmine L. Mah, Karen K. Christensen-Dalsgaard, Sally P. Leys: Choanoflagellate and choanocyte collar-flagellar systems and the assumption of homology. In: Evolution & Development. Band 16, 2014, doi:10.1111/ede.12060, S. 25.
- ↑ Peter Ax: Das System der Metazoa I. Ein Lehrbuch der phylogenetischen Systematik. Gustav Fischer Verlag, Stuttgart/Jena/New York 1995, ISBN 3-437-30803-3, S. 58–59.
- ↑ a b Casey W. Dunn, Sally P. Leys, Steven H.D. Haddock: The hidden biology of sponges and ctenophores. In: Trends in Ecology & Evolution. Band 30, 2015, doi:10.1016/j.tree.2015.03.003, S. 287.
- ↑ Denis V. Tikhonenkov, Kirill V. Mikhailov, Elisabeth Hehenberger, Sergei A. Karpov, Kristina I. Prokina, Anton S. Esaulov, Olga I. Belyakova, Yuri A. Mazei, Alexander P. Mylnikov, Vladimir V. Aleoshin, Patrick J. Keeling: New Lineage of Microbial Predators Adds Complexity to Reconstructing the Evolutionary Origin of Animals. In: Current Biology. Band 30, 2020, doi:10.2139/ssrn.3606769, S. 4504 (S. 5).
- ↑ Kamran Shalchian-Tabrizi, Marianne A. Minge, Mari Espelund, Russell Orr, Torgeir Ruden, Kjetill S. Jakobsen, Thomas Cavalier-Smith: Multigene Phylogeny of Choanozoa and the Origin of Animals. In: PLOS One. Band 3, 2008, e2098, doi:10.1371/journal.pone.0002098, S. 5.
- ↑ Guifré Torruella, Romain Derelle, Jordi Paps, B. Franz Lang, Andrew J. Roger, Kamran Shalchian-Tabrizi, Iñaki Ruiz-Trillo: Phylogenetic Relationships within the Opisthokonta Based on Phylogenomic Analyses of Conserved Single-Copy Protein Domains. In: Molecular Biology and Evolution. Band 29, 2011, doi:10.1093/molbev/msr185, S. 536.
- ↑ Salma Sana, Emilie A. Hardouin, Richard Paley, Tiantian Zhang, Demetra Andreou: The complete mitochondrial genome of a parasite at the animal-fungal boundary. In: Parasites & Vectors. Band 13, 2020, Artikel-Nr. 81, doi:10.1186/s13071-020-3926-5, S. 2.
- ↑ Victoria Shabardina, Jennah E. Dharamshi, Patricia S. Ara, Meritxell Antó, Fernando J. Bascón, Hiroshi Suga, Wyth Marshall, Claudio Scazzocchio, Elena Casacuberta, Iñaki Ruiz-Trillo: Ichthyosporea: a window into the origin of animals. In: Communications Biology, Band 7, Nr. 915, 29. Juli 2024; doi:10.1038/s42003-024-06608-5 (englisch).
- ↑ Thomas Cavalier-Smith, M.T.E. Paula Allsopp: Corallochytrium, an enigmatic non-flagellate protozoan related to choanoflagellates. In: European Journal of Protistology. Band 32, 1996, doi:10.1016/S0932-4739(96)80053-8, S. 306.
- ↑ Elisabeth Hehenberger, Denis V. Tikhonenkov, Martin Kolisko, Javier del Campo, Anton S. Esaulov, Alexander P. Mylnikov, Patrick J. Keeling: Novel Predators Reshape Holozoan Phylogeny and Reveal the Presence of a Two-Component Signaling System in the Ancestor of Animals. In: Current Biology. Band 27, 2017, doi:10.1016/j.cub.2017.06.006, S. 2043, e2.
- ↑ Elisabeth Hehenberger, Denis V. Tikhonenkov, Martin Kolisko, Javier del Campo, Anton S. Esaulov, Alexander P. Mylnikov, Patrick J. Keeling: Novel Predators Reshape Holozoan Phylogeny and Reveal the Presence of a Two-Component Signaling System in the Ancestor of Animals. In: Current Biology. Band 27, 2017, doi:10.1016/j.cub.2017.06.006, S. 2045.
- ↑ Frank Nitsche, Martin Carr, Hartmut Arndt, Barry S.C. Leadbeater: Higher Level Taxonomy and Molecular Phylogenetics of the Choanoflagellatea. In: Journal of Eukaryotic Microbiology. Band 58, 2011, doi:10.1111/j.1550-7408.2011.00572.x, S. 452.
- ↑ Martin Dohrmann, Gert Wörheide: Dating early animal evolution using phylogenomic data. In: Scientific Reports. Band 7, 2017, Artikel Nr. 3599, doi:10.1038/s41598-017-03791-w, S. 4.
- ↑ Martin Carr, Daniel J. Richter, Parinaz Fozouni, Timothy J. Smith, Alexandra Jeuck, Barry S.C. Leadbeater, Frank Nitsche: A six-gene phylogeny provides new insights into choanoflagellate evolution. In: Molecular Phylogenetics and Evolution. Band 107, 2017, doi:10.1016/j.ympev.2016.10.011, S. 166–167, 172.
- ↑ Mark J.Dayel, Rosanna A. Alegado, Stephen R. Fairclough, Tera C. Levin, Scott A. Nichols, Kent McDonald, Nicole King: Cell differentiation and morphogenesis in the colony-forming choanoflagellate Salpingoeca rosetta. In: Developmental Biology. Band 357, 2011, doi:10.1016/j.ydbio.2011.06.003, S. 73.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 44, 230.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 2, 4.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 44.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 18.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 239.
- ↑ Julia M. Brown, Jessica M. Labonté, Joseph Brown, Nicholas R. Record, Nicole J. Poulton, Michael E. Sieracki, Ramiro Logares, Ramunas Stepanauskas: Single Cell Genomics Reveals Viruses Consumed by Marine Protists. In: Frontiers in Microbiology. Band 11, 2020, Artikel Nr. 524828, doi:10.3389/fmicb.2020.524828, S. 8–9.
- ↑ Thomas Cavalier-Smith: Origin of animal multicellularity: precursors, causes, consequences — the choanoflagellate/sponge transition, neurogenesis and the Cambrian explosion. In: Philosophical Transactions of the Royal Society B. Band 372, 2017, doi:10.1098/rstb.2015.0476, Artikel Nr. 20150476, S. 1.
- ↑ Peter Sitte: Morphologie. In: Peter Sitte, Hubert Ziegler, Friedrich Ehrendorfer, Andreas Bresinsky: Strasbuger • Lehrbuch der Botanik. Gustav Fischer Verlag, 34. Auflage, Stuttgart/Jena/Lübeck/Ulm 1998, ISBN 978-3437255007, S. 207–209.
- ↑ Richard K. Grosberg, Richard R. Strathmann: The Evolution of Multicellularity: A Minor Major Transition? In: Annual Review of Ecology, Evolution, and Systematics. Band 38, 2007, doi:10.1146/annurev.ecolsys.36.102403.114735, S. 623.
- ↑ a b Daniel B. Mills, Donald E. Canfield: Oxygen and animal evolution: Did a rise of atmospheric oxygen trigger the origin of animals?. In: Bioessays. Band 36, 2014, doi:10.1002/bies.201400101, S. 1149.
- ↑ Aaron L. Fidler, Carl E. Darris, Sergei V. Chetyrkin, Vadim K. Pedchenko, Sergei P. Boudko, Kyle L. Brown, W. Gray Jerome, Julie K. Hudson, Antonis Rokas, Billy G. Hudson: Collagen IV and basement membrane at the evolutionary dawn of metazoan tissues. In: eLife. Band 6, 2017, Artikel Nr. e24176, doi:10.7554/eLife.24176, S. 4–5.
- ↑ a b Daniel J. Richter, Nicole King: The Genomic and Cellular Foundations of Animal Origins. In: Annual Review of Genetics. Band 47, 2013, doi:10.1146/annurev-genet-111212-133456, S. 509–510.
- ↑ a b c Paschalia Kapli, Maximilian J. Telford: Topology-dependent asymmetry in systematic errors affects phylogenetic placement of Ctenophora and Xenacoelomorpha. In: Science Advances. Band 6, 2020, Artikel eabc5162, doi:10.1126/sciadv.abc5162, S. 7.
- ↑ a b Graham E. Budd, and Sören Jensen: The origin of the animals and a ‘Savannah’ hypothesis for early bilaterian evolution. In: Biological Reviews. Band 92, 2017, doi:10.1111/brv.12239, S. 452.
- ↑ Volker Storch, Ulrich Welsch: Kükenthal · Zoologisches Praktikum. Springer Spektrum Verlag, 27. Auflage, Berlin/Heidelberg 2014, ISBN 978-3642419362, S. 466: „Der verbreiteten Auffassung, dass Schwämme keine echten Gewebe bilden, wird auch widersprochen; desungeachtet nehmen die Schwämme auch auf histologischer Ebene eine isolierte, einzigartige Stellung ein.“
- ↑ Emmanuelle Renard, Jean Vacelet, Eve Gazave, Pascal Lapébie, Carole Borchiellini, Alexander V Ereskovsky: Origin of the neuro-sensory system: new and expected insights from sponges. In: Integrative Zoology. Band 4, 2009, doi:10.1111/j.1749-4877.2009.00167.x, S. 299.
- ↑ Jeffrey Colgren, Scott A. Nichols: The significance of sponges for comparative studies of developmental evolution. In: Wiley Interdisciplinary Reviews: Developmental Biology. Band 9, 2020, doi:10.1002/wdev.359, Artikel Nr. e359, S. 1: „We then present a case study to illustrate how contractile epithelia in sponges can help unravel the complex ancestry of an ancient animal cell type, myocytes, which sponges lack.“
- ↑ Roland M. Bagby: The fine structure of myocytes in the sponges Microciona prolifera (Ellis and Solander) and Tedania ignis (Duchassaing and Michelotti)†. In: Journal of Morphology. Band 118, 1966, doi:10.1002/jmor.1051180203, S. 167: „Myocytes are long, fusiform cells found in the osculum and other contractile areas of many sponges.“
- ↑ Hans Ulrik Riisgård, Poul S. Larsen: Actual and Model-Predicted Growth of Sponges—With a Bioenergetic Comparison to Other Filter-Feeders. In: Journal of Marine Science and Engineering. Band 10, 2022, doi:10.3390/jmse10050607, Artikel Nr. 607, S. 1: „Although sponges lack nerves and muscle tissues, coordinated contraction-expansion responses, including partial or complete closure of the osculum to mechanical and chemical stimuli, are common among sponges due to the presence of contractile cells (myocytes), which results in temporary reduced or arrested water flow.“
- ↑ Detlev Arendt: Elementary nervous systems. In: Philosophical Transactions of the Royal Society B. Band 376, 2020, doi:10.1098/rstb.2020.0347, Artikel Nr. 20200347, S. 6, 9.
- ↑ Jean Vacelet, NicoleBoury-Esnault: Carnivorous sponges. In: Nature. Band 373, 1995, doi:10.1016/j.ympev.2015.08.022, S. 333.
- ↑ Henry M. Reiswig: Bacteria as food for temperate-water marine sponges. In: Canadian Journal of Zoology. Band 53, 1975, doi:10.1139/z75-072, S. 582.
- ↑ Gonzalo Giribet, Gregory D. Edgecombe: The Invertebrate Tree of Life. Princeton University Press, Princeton/Oxford 2020, ISBN 978-0691170251, S. 38.
- ↑ Manuel Maldonado: Choanoflagellates, choanocytes, and animal multicellularity. In: Invertebrate Biology. Band 123, 2004, doi:10.1111/j.1744-7410.2004.tb00138.x, S. 1.
- ↑ Peter Ax: Das System der Metazoa I. Ein Lehrbuch der phylogenetischen Systematik. Gustav Fischer Verlag, Stuttgart/Jena/New York 1995, ISBN 3-437-30803-3, S. 76: „Das Wort Epithel wird eindeutig definiert, wenn der resultierende Terminus nur für Zellschichten mit Gürteldesmosomen verwendet wird. Wir haben deshalb das Pinacoderm und Choanoderm der Schwämme ganz bewusst nicht als Epithel bezeichnet.“
- ↑ Peter Ax: Das System der Metazoa I. Ein Lehrbuch der phylogenetischen Systematik. Gustav Fischer Verlag, Stuttgart/Jena/New York 1995, ISBN 3-437-30803-3, S. 76.
- ↑ Martin Dohrmann, Gert Wörheide: Novel Scenarios of Early Animal Evolution—Is It Time to Rewrite Textbooks?. In: Integrative and Comparative Biology. Band 53, 2013, S. 504.
- ↑ Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 2, 3.
- ↑ a b c d e Thomas Cavalier-Smith: Origin of animal multicellularity: precursors, causes, consequences — the choanoflagellate/sponge transition, neurogenesis and the Cambrian explosion. In: Philosophical Transactions of the Royal Society B. Band 372, 2017, doi:10.1098/rstb.2015.0476, Artikel Nr. 20150476, S. 5.
- ↑ a b Claus Nielsen: Six major steps in animal evolution: are we derived sponge larvae?. In: Evolution & Development. Band 10, 2008, doi:10.1111/j.1525-142X.2008.00231.x, S. 243–246.
- ↑ a b c d Martin Dohrmann, Gert Wörheide: Dating early animal evolution using phylogenomic data. In: Scientific Reports. Band 7, 2017, Artikel Nr. 3599, doi:10.1038/s41598-017-03791-w, S. 3–4.
- ↑ Kamran Shalchian-Tabrizi, Marianne A. Minge, Mari Espelund, Russell Orr, Torgeir Ruden, Kjetill S. Jakobsen, Thomas Cavalier-Smith: Multigene Phylogeny of Choanozoa and the Origin of Animals. In: PLOS One. Band 3, 2008, e2098, doi:10.1371/journal.pone.0002098, S. 4–5.
- ↑ Arnau Sebé-Pedrós, Pawel Burkhardt, Núria Sánchez-Pons, Stephen R. Fairclough, B. Franz Lang, Nicole King, Iñaki Ruiz-Trillo: Insights into the Origin of Metazoan Filopodia and Microvilli. In: Molecular Biology and Evolution. Band 30, 2013, doi:10.1093/molbev/mst110, S. 2013–2014.
- ↑ Miguel A. Naranjo-Ortiz, Toni Gabaldón: Fungal evolution: diversity, taxonomy and phylogeny of the Fungi. In: Biological Reviews. Band 94, 2019, doi:10.1111/brv.12550, S. 2107.
- ↑ Arnau Sebé-Pedrós, Pawel Burkhardt, Núria Sánchez-Pons, Stephen R. Fairclough, B. Franz Lang, Nicole King, Iñaki Ruiz-Trillo: Insights into the Origin of Metazoan Filopodia and Microvilli. In: Molecular Biology and Evolution. Band 30, 2013, doi:10.1093/molbev/mst110, S. 2017.
- ↑ Arnau Sebé-Pedrós, Pawel Burkhardt, Núria Sánchez-Pons, Stephen R. Fairclough, B. Franz Lang, Nicole King, Iñaki Ruiz-Trillo: Insights into the Origin of Metazoan Filopodia and Microvilli. In: Molecular Biology and Evolution. Band 30, 2013, doi:10.1093/molbev/mst110, S. 2013, 2020.
- ↑ Oleg Simakov, Jessen Bredeson, Kodiak Berkoff, Ferdinand Marletaz, Therese Mitros, Darrin T. Schultz, Brendan L. O’Connell, Paul Dear, Daniel E. Martinez, Robert E. Steele, Richard E. Green, Charles N. David, Daniel S. Rokhsar: Deeply conserved synteny and the evolution of metazoan chromosomes. In: Science Advances. Band 8, 2022, Artikel Nr. eabi5884, doi:10.1126/sciadv.abi5884, S. 10.
- ↑ Oleg Simakov, Jessen Bredeson, Kodiak Berkoff, Ferdinand Marletaz, Therese Mitros, Darrin T. Schultz, Brendan L. O’Connell, Paul Dear, Daniel E. Martinez, Robert E. Steele, Richard E. Green, Charles N. David, Daniel S. Rokhsar: Deeply conserved synteny and the evolution of metazoan chromosomes. In: Science Advances. Band 8, 2022, Artikel Nr. eabi5884, doi:10.1126/sciadv.abi5884, S. 2.
- ↑ Ming Tang, Xu Chu, Jihua Hao, Bing Shen: Orogenic quiescence in Earth’s middle age. In: Science. Band 371, 2021, doi:10.1126/science.abf1876, S. 729.
- ↑ Mansi Srivastava, Oleg Simakov, Jarrod Chapman, Bryony Fahey, Marie E. A. Gauthier, Therese Mitros, Gemma S. Richards, Cecilia Conaco, Michael Dacre, Uffe Hellsten, Claire Larroux, Nicholas H. Putnam, Mario Stanke, Maja Adamska, Aaron Darling, Sandie M. Degnan, Todd H. Oakley, David C. Plachetzki, Yufeng Zhai, Marcin Adamski, Andrew Calcino, Scott F. Cummins, David M. Goodstein, Christina Harris, Daniel J. Jackson, Sally P. Leys, Shengqiang Shu, Ben J. Woodcroft, Michel Vervoort, Kenneth S. Kosik, Gerard Manning, Bernard M. Degnan, Daniel S. Rokhsar: The Amphimedon queenslandica genome and the evolution of animal complexity. In: Nature. Band 466, 2010, doi:10.1038/nature09201, S. 723–724.
- ↑ a b c Scott Anthony Nichols, Brock William Roberts, Daniel Joseph Richter, Stephen Robert Fairclough, Nicole King: Origin of metazoan cadherin diversity and the antiquity of the classical cadherin/β-catenin complex. In: PNAS. Band 109, 2012, doi:10.1073/pnas.1120685109, S. 13046.
- ↑ Scott Anthony Nichols, Brock William Roberts, Daniel Joseph Richter, Stephen Robert Fairclough, Nicole King: Origin of metazoan cadherin diversity and the antiquity of the classical cadherin/β-catenin complex. In: PNAS. Band 109, 2012, doi:10.1073/pnas.1120685109, S. 13047, 13049–13050.
- ↑ Nicole King, Christopher T. Hittinger, Sean B. Carroll: Evolution of key cell signaling and adhesion protein families predates animal origins. In: Science. 301. Jahrgang, Nr. 5631, Juli 2003, S. 361–363, doi:10.1126/science.1083853, PMID 12869759, bibcode:2003Sci...301..361K (englisch).
- ↑ Paul K. Strother, Martin D. Brasier, David Wacey, Leslie Timpe, Martin Saunders, Charles H. Wellman: A possible billion-year-old holozoan with differentiated multicellularity. In: Current Biology. Band 31, 2021, doi:10.1016/j.cub.2021.03.051, S. 2658–2665.
- ↑ Scott Anthony Nichols, Brock William Roberts, Daniel Joseph Richter, Stephen Robert Fairclough, Nicole King: Origin of metazoan cadherin diversity and the antiquity of the classical cadherin/β-catenin complex. In: PNAS. Band 109, 2012, doi:10.1073/pnas.1120685109, S. 13049.
- ↑ a b Scott Anthony Nichols, Brock William Roberts, Daniel Joseph Richter, Stephen Robert Fairclough, Nicole King: Origin of metazoan cadherin diversity and the antiquity of the classical cadherin/β-catenin complex. In: PNAS. Band 109, 2012, doi:10.1073/pnas.1120685109, S. 13050.
- ↑ Scott Anthony Nichols, Brock William Roberts, Daniel Joseph Richter, Stephen Robert Fairclough, Nicole King: Origin of metazoan cadherin diversity and the antiquity of the classical cadherin/β-catenin complex. In: PNAS. Band 109, 2012, doi:10.1073/pnas.1120685109, S. 13048.
- ↑ Scott Anthony Nichols, Brock William Roberts, Daniel Joseph Richter, Stephen Robert Fairclough, Nicole King: Origin of metazoan cadherin diversity and the antiquity of the classical cadherin/β-catenin complex. In: PNAS. Band 109, 2012, doi:10.1073/pnas.1120685109, S. 13046–13049.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 14.
- ↑ Thibaut Brunet, Nicole King: The Origin of Animal Multicellularity and Cell Differentiation. In: Developmental Cell. Band 43, 2017, doi:10.1016/j.devcel.2017.09.016, S. 130.
- ↑ Julius von Kennel: Lehrbuch der Zoologie. Verlag Ferdinand Enke, Stuttgart, 1893, S. 167.
- ↑ Aaron L. Fidler, Carl E. Darris, Sergei V. Chetyrkin, Vadim K. Pedchenko, Sergei P. Boudko, Kyle L. Brown, W. Gray Jerome, Julie K. Hudson, Antonis Rokas, Billy G. Hudson: Collagen IV and basement membrane at the evolutionary dawn of metazoan tissues. In: eLife. Band 6, 2017, Artikel Nr. e24176, doi:10.7554/eLife.24176, S. 1, 18.
- ↑ Aaron L. Fidler, Carl E. Darris, Sergei V. Chetyrkin, Vadim K. Pedchenko, Sergei P. Boudko, Kyle L. Brown, W. Gray Jerome, Julie K. Hudson, Antonis Rokas, Billy G. Hudson: Collagen IV and basement membrane at the evolutionary dawn of metazoan tissues. In: eLife. Band 6, 2017, Artikel Nr. e24176, doi:10.7554/eLife.24176, S. 18.
- ↑ Aaron L. Fidler, Carl E. Darris, Sergei V. Chetyrkin, Vadim K. Pedchenko, Sergei P. Boudko, Kyle L. Brown, W. Gray Jerome, Julie K. Hudson, Antonis Rokas, Billy G. Hudson: Collagen IV and basement membrane at the evolutionary dawn of metazoan tissues. In: eLife. Band 6, 2017, Artikel Nr. e24176, doi:10.7554/eLife.24176, S. 11.
- ↑ Dale Kaiser: Building a multicellular organism. In: Annual Review of Genetics. Band 35, 2001, doi:10.1146/annurev.genet.35.102401.090145, S. 117, 120.
- ↑ Richard K. Grosberg, Richard R. Strathmann: The Evolution of Multicellularity: A Minor Major Transition? In: Annual Review of Ecology, Evolution, and Systematics. Band 38, 2007, doi:10.1146/annurev.ecolsys.36.102403.114735, S. 628.
- ↑ Matthew D. Herron, Joshua M. Borin, Jacob C. Boswell, Jillian Walker, I-Chen Kimberly Chen, Charles A. Knox, Margrethe Boyd, Frank Rosenzweig, William C. Ratcliff: De novo origins of multicellularity in response to predation. In: Scientific Reports. Band 9, 2019, doi:10.1038/s41598-019-39558-8, Artikel Nr. 2328.
- ↑ Joana P. Bernardes, Uwe John, Noemi Woltermann, Martha Valiadi, Ruben J. Hermann, Lutz Becks: The evolution of convex trade-offs enables the transition towards multicellularity. In: Nature Communications. Band 12, 2021, Artikel Nr. 4222, doi:10.1038/s41467-021-24503-z, S. 6.
- ↑ Joana P. Bernardes, Uwe John, Noemi Woltermann, Martha Valiadi, Ruben J. Hermann, Lutz Becks: The evolution of convex trade-offs enables the transition towards multicellularity. In: Nature Communications. Band 12, 2021, Artikel Nr. 4222, doi:10.1038/s41467-021-24503-z, S. 2.
- ↑ Barry S. C. Leadbeater: The Choanoflagellates. Cambridge University Press, Cambridge 2015, ISBN 978-0521884440, S. 13–14.
- ↑ a b Mark J. Dayel, Rosanna A. Alegado, Stephen R. Fairclough, Tera C. Levin, Scott A. Nichols, Kent McDonald, Nicole King: Cell differentiation and morphogenesis in the colony-forming choanoflagellate Salpingoeca rosetta. In: Developmental Biology. Band 357, 2011, doi:10.1016/j.ydbio.2011.06.003, S. 76.
- ↑ Hoa Nguyen, Mimi A.R. Koehl, Christian Oakes, Greg Bustamante, Lisa Fauci: Effects of cell morphology and attachment to a surface on the hydrodynamic performance of unicellular choanoflagellates. In: Journal of the Royal Society Interface. Band 16, 2019, Artikel Nr. 20180736, doi:10.1098/rsif.2018.0736, S. 1.
- ↑ Mark J. Dayel, Rosanna A. Alegado, Stephen R. Fairclough, Tera C. Levin, Scott A. Nichols, Kent McDonald, Nicole King: Cell differentiation and morphogenesis in the colony-forming choanoflagellate Salpingoeca rosetta. In: Developmental Biology. Band 357, 2011, doi:10.1016/j.ydbio.2011.06.003, S. 75.
- ↑ Rosanna A. Alegado, Laura W. Brown, Shugeng Cao, Renee K. Dermenjian, Richard Zuzow, Stephen R. Fairclough, Jon Clardy, Nicole King: A bacterial sulfonolipid triggers multicellular development in the closest living relatives of animals. In: eLife. Band 1, 2012, Artikel Nr. e00013, doi:10.7554/eLife.00013, S. 7, 10.
- ↑ Rosanna A. Alegado, Laura W. Brown, Shugeng Cao, Renee K. Dermenjian, Richard Zuzow, Stephen R. Fairclough, Jon Clardy, Nicole King: A bacterial sulfonolipid triggers multicellular development in the closest living relatives of animals. In: eLife. Band 1, 2012, Artikel Nr. e00013, doi:10.7554/eLife.00013, S. 5, 6.
- ↑ Rosanna A. Alegado, Laura W. Brown, Shugeng Cao, Renee K. Dermenjian, Richard Zuzow, Stephen R. Fairclough, Jon Clardy, Nicole King: A bacterial sulfonolipid triggers multicellular development in the closest living relatives of animals. In: eLife. Band 1, 2012, Artikel Nr. e00013, doi:10.7554/eLife.00013, S. 6.
- ↑ Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amoeboid switch in the closest living relatives of animals. In: eLife. Band 10, 2021, Artikel Nr. e61037, doi:10.7554/eLife.61037, S. 2.
- ↑ Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 2, 7.
- ↑ Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 1, 2, 7, 8, 11–12.
- ↑ Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 8.
- ↑ a b Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 12.
- ↑ Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 1, 5, 6, 11.
- ↑ a b Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 5.
- ↑ Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 6, Abb. 2B Mitte.
- ↑ Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 6, 7.
- ↑ Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 7, Abb. 4M und 4N.
- ↑ Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 1, 7, 8, 12.
- ↑ Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 1, 4, 11, 12.
- ↑ K. H. Hake, Patrick T. West, Kent L. McDonald, Davis Laundon, Crystal Feng, Pawel Burkhardt, Daniel J. Richter, Jill Banfield, Nicole King: A large colonial choanoflagellate from Mono Lake harbors live bacteria. In: mBio. Band 15, 2024, doi:10.1128/mbio.01623-24, Artikel Nr. 15:e01623-24, Abbildung 1, S. 2–3.
- ↑ a b Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amoeboid switch in the closest living relatives of animals. In: eLife. Band 10, 2021, Artikel Nr. e61037, doi:10.7554/eLife.61037, S. 3.
- ↑ a b Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amoeboid switch in the closest living relatives of animals. In: eLife. Band 10, 2021, Artikel Nr. e61037, doi:10.7554/eLife.61037, S. 1.
- ↑ Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amoeboid switch in the closest living relatives of animals. In: eLife. Band 10, 2021, Artikel Nr. e61037, doi:10.7554/eLife.61037, S. 3–5.
- ↑ Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amoeboid switch in the closest living relatives of animals. In: eLife. Band 10, 2021, Artikel Nr. e61037, doi:10.7554/eLife.61037, S. 9.
- ↑ Thibaut Brunet, Marvin Albert, William Roman, Maxwell C. Coyle, Danielle C. Spitzer, Nicole King: A flagellate-to-amoeboid switch in the closest living relatives of animals. In: eLife. Band 10, 2021, Artikel Nr. e61037, doi:10.7554/eLife.61037, S. 10.
- ↑ Shunsuke Sogabe, William L. Hatleberg, Kevin M. Kocot, Tahsha E. Say, Daniel Stoupin, Kathrein E. Roper, Selene L. Fernandez-Valverde, Sandie M. Degnan, Bernard M. Degnan: Pluripotency and the origin of animal multicellularity. In: Nature. Band 570, 2019, doi:10.1038/s41586-019-1290-4, S. 519, 521–522.
- ↑ Shunsuke Sogabe, William L. Hatleberg, Kevin M. Kocot, Tahsha E. Say, Daniel Stoupin, Kathrein E. Roper, Selene L. Fernandez-Valverde, Sandie M. Degnan, Bernard M. Degnan: Pluripotency and the origin of animal multicellularity. In: Nature. Band 570, 2019, doi:10.1038/s41586-019-1290-4, S. 521.
- ↑ Shunsuke Sogabe, William L. Hatleberg, Kevin M. Kocot, Tahsha E. Say, Daniel Stoupin, Kathrein E. Roper, Selene L. Fernandez-Valverde, Sandie M. Degnan, Bernard M. Degnan: Pluripotency and the origin of animal multicellularity. In: Nature. Band 570, 2019, doi:10.1038/s41586-019-1290-4, S. 519, 522.
- ↑ Davis Laundon, Ben T. Larson, Kent McDonald, Nicole King, Pawel Burkhardt: The architecture of cell differentiation in choanoflagellates and sponge choanocytes. In: PLOS Biology. Band 17, 2019, doi:10.1371/journal.pbio.3000226, Artikel Nr. e3000226, S. 2.
- ↑ Shunsuke Sogabe, William L. Hatleberg, Kevin M. Kocot, Tahsha E. Say, Daniel Stoupin, Kathrein E. Roper, Selene L. Fernandez-Valverde, Sandie M. Degnan, Bernard M. Degnan: Pluripotency and the origin of animal multicellularity. In: Nature. Band 570, 2019, doi:10.1038/s41586-019-1290-4, S. 522.
- ↑ John A. Cunningham, Alexander G. Liu, Stefan Bengtson, Philip C. J. Donoghue: The origin of animals: Can molecular clocks and the fossil record be reconciled? In: BioEssays. Band 39, 2016, doi:10.1002/bies.201600120, S. 1.
- ↑ Jonathan B. Antcliffe, Richard H. T. Callow, Martin D. Brasier: Giving the early fossil record of sponges a squeeze. In: Biological Reviews. Band 89, 2014, doi:10.1111/brv.12090, S. 972 (S. 1).
- ↑ a b Ilya Bobrovskiy, Janet M. Hope, Andrey Ivantsov, Benjamin J. Nettersheim, Christian Hallmann, Jochen J. Brocks: Ancient steroids establish the Ediacaran fossil Dickinsonia as one of the earliest animals. In: Science, Band 361, 2018, doi:10.1126/science.aat7228, S. 1246–1249.
- ↑ Qing Tang, Bin Wan, Xunlai Yuan, A.D. Muscente, Shuhai Xiao: Spiculogenesis and biomineralization in early sponge animals. In: Nature Communications. Band 10, 2019, Artikel Nr. 3348, doi:10.1038/s41467-019-11297-4, S. 9.
- ↑ Zongjun Yin, Maoyan Zhu, Eric H. Davidson, David J. Bottjer, Fangchen Zhao, Paul Tafforeau: Sponge grade body fossil with cellular resolution dating 60 Myr before the Cambrian. In: PNAS. Band 112, 2015, doi:10.1073/pnas.1414577112, S. E1457.
- ↑ a b Elizabeth C. Turner: Possible poriferan body fossils in early Neoproterozoic microbial reefs. In: Nature. Band 596, 2021, doi:10.1038/s41586-021-03773-z, S. 87–88 (S. 1–2).
- ↑ Dirk Erpenbeck, Steve C. de Cook, Andreas Dietzel, Patricia Hendriks, Colleen Strickland, Merrick Ekins, Bernard M. Degnan, John N.A. Hooper, Gert Wörheide: Molecular und biochemical systematics of sponges (Porifera) without mineral skeleton. In: Stephan Robbert Gradstein, Simone Klatt, Felix Normann, Patrick Weigelt, Rainer Willmann, Rosemary Wilson (Hrsg.): Systematics 2008 • Programme and Abstracts. Universitätsverlag Göttingen, Göttingen 2008, ISBN 978-3-940344-23-6, S. 194.
- ↑ Elizabeth C. Turner: Possible poriferan body fossils in early Neoproterozoic microbial reefs. In: Nature. Band 596, 2021, doi:10.1038/s41586-021-03773-z, S. 90 (S. 4).
- ↑ Elisa Maria Costa-Paiva, Beatriz Mello, Bruno Santos Bezerra, Christopher J. Coates, Kenneth M. Halanych, Federico Brown, Juliana de Moraes Leme, Ricardo I. F. Trindade: Molecular dating of the blood pigment hemocyanin provides new insight into the origin of animals. In: Geobiology. Band 20, 2022, doi:10.1111/gbi.12481, S. 333, 340–341.
- ↑ Charles Kimberlin 'Bob' Brain, Anthony R. Prave, Karl-Heinz Hoffmann, Anthony E. Fallick, Andre Botha, Donald A. Herd, Craig Sturrock, Iain Young, Daniel J. Condon, Stuart G. Allison: The first animals: ca. 760-million-year-old sponge-like fossils from Namibia. In: South African Journal of Science. Band 108, 2012, Artikel Nr. 658, doi:10.4102/sajs.v108i1/2.658, S. 3, 5.
- ↑ a b Charles Kimberlin 'Bob' Brain, Anthony R. Prave, Karl-Heinz Hoffmann, Anthony E. Fallick, Andre Botha, Donald A. Herd, Craig Sturrock, Iain Young, Daniel J. Condon, Stuart G. Allison: The first animals: ca. 760-million-year-old sponge-like fossils from Namibia. In: South African Journal of Science. Band 108, 2012, Artikel Nr. 658, doi:10.4102/sajs.v108i1/2.658, S. 7.
- ↑ Jonathan B. Antcliffe, Richard H. T. Callow, Martin D. Brasier: Giving the early fossil record of sponges a squeeze. In: Biological Reviews. Band 89, 2014, doi:10.1111/brv.12090, S. 982 (S. 11).
- ↑ Scott MacLennan, Yuem Park, Nicholas Swanson-Hysell, Adam Maloof, Blair Schoene, Mulubrhan Gebreslassie, Eliel Antilla, Tadele Tesema, Mulugeta Alene, Bereket Haileab: The arc of the Snowball: U-Pb dates constrain the Islay anomaly and the initiation of the Sturtian glaciation. In: Geology. Band 46, 2018, doi:10.1130/G40171.1, S. 3–4.
- ↑ Elias J. Rugen, Guido Pastore, Pieter Vermeesch, Anthony M. Spencer, David Webster, Adam G. G. Smith, Andrew Carter, Graham A. Shields: Glacially influenced provenance and Sturtian affinity revealed by detrital zircon U–Pb ages from sandstones in the Port Askaig Formation, Dalradian Supergroup. In: Journal of the Geological Society. Band 181, 2024, doi:10.1144/jgs2024-029, S. 1, 6.
- ↑ Elias J. Rugen, Guido Pastore, Pieter Vermeesch, Anthony M. Spencer, David Webster, Adam G. G. Smith, Andrew Carter, Graham A. Shields: Glacially influenced provenance and Sturtian affinity revealed by detrital zircon U–Pb ages from sandstones in the Port Askaig Formation, Dalradian Supergroup. In: Journal of the Geological Society. Band 181, 2024, doi:10.1144/jgs2024-029, S. 1.
- ↑ Erik A. Sperling, Charles J. Wolock, Alex S. Morgan, Benjamin C. Gill, Marcus Kunzmann, Galen P. Halverson, Francis A. Macdonald, Andrew H. Knoll, David T. Johnston: Statistical analysis of iron geochemical data suggests limited late Proterozoic oxygenation. In: Nature. Band 523, 2015, doi:10.1038/nature14589, S. 451.
- ↑ a b Maxwell A. Lechte, Malcolm W. Wallace, Ashleigh van Smeerdijk Hood, Weiqiang Li, Ganqing Jiang, Galen P. Halverson, Dan Asael, Stephanie L. McColl, Noah J. Planavsky: Subglacial meltwater supported aerobic marine habitats during Snowball Earth. In: PNAS. Band 116, 2019, doi:10.1073/pnas.1909165116, S. 25478.
- ↑ Philip A. Allen, James L. Etienne: Sedimentary challenge to Snowball Earth. In: Nature Geoscience. Band 1, 2008, doi:10.1038/ngeo355, S. 824.
- ↑ Wei Wei, Robert Frei, Robert Klaebe, Da Li, Guang-Yi Wei, Hong-Fei Ling: Redox condition in the Nanhua Basin during the waning of the Sturtian glaciation: A chromium-isotope perspective. In: Precambrian Research. Band 319, 2018, doi:10.1016/j.precamres.2018.02.009, S. 1, 10.
- ↑ Paul F. Hoffman, Dorian S. Abbot, Yosef Ashkenazy, Douglas I. Benn, Jochen J. Brocks, Phoebe A. Cohen, Grant M. Cox, Jessica R. Creveling, Yannick Donnadieu, Douglas H. Erwin, Ian J. Fairchild, David Ferreira, Jason C. Goodman, Galen P. Halverson, Malte F. Jansen, Guillaume Le Hir, Gordon D. Love, Francis A. Macdonald, Adam C. Maloof, Camille A. Partin, Gilles Ramstein, Brian E. J. Rose, Catherine V. Rose, Peter M. Sadler, Eli Tziperman, Aiko Voigt, Stephen G. Warren: Snowball Earth climate dynamics and Cryogenian geology-geobiology. In: Science Advances. Band 3, 2017, Artikel Nr. e1600983, doi:10.1126/sciadv.1600983, S. 14–16.
- ↑ Paul F. Hoffman, Dorian S. Abbot, Yosef Ashkenazy, Douglas I. Benn, Jochen J. Brocks, Phoebe A. Cohen, Grant M. Cox, Jessica R. Creveling, Yannick Donnadieu, Douglas H. Erwin, Ian J. Fairchild, David Ferreira, Jason C. Goodman, Galen P. Halverson, Malte F. Jansen, Guillaume Le Hir, Gordon D. Love, Francis A. Macdonald, Adam C. Maloof, Camille A. Partin, Gilles Ramstein, Brian E. J. Rose, Catherine V. Rose, Peter M. Sadler, Eli Tziperman, Aiko Voigt, Stephen G. Warren: Snowball Earth climate dynamics and Cryogenian geology-geobiology. In: Science Advances. Band 3, 2017, Artikel Nr. e1600983, doi:10.1126/sciadv.1600983, S. 20–21.
- ↑ Wei Wei, Robert Frei, Robert Klaebe, Da Li, Guang-Yi Wei, Hong-Fei Ling: Redox condition in the Nanhua Basin during the waning of the Sturtian glaciation: A chromium-isotope perspective. In: Precambrian Research. Band 319, 2018, doi:10.1016/j.precamres.2018.02.009, S. 10.
- ↑ Maxwell A. Lechte, Malcolm W. Wallace, Ashleigh van Smeerdijk Hood, Weiqiang Li, Ganqing Jiang, Galen P. Halverson, Dan Asael, Stephanie L. McColl, Noah J. Planavsky: Subglacial meltwater supported aerobic marine habitats during Snowball Earth. In: PNAS. Band 116, 2019, doi:10.1073/pnas.1909165116, S. 25481–25482.
- ↑ Henry M. Reiswig, Tanya L. Miller: Freshwater Sponge Gemmules Survive Months of Anoxia. In: Invertebrate Biology. Band 117, 1998, doi:10.2307/3226846, S. 1.
- ↑ Daniel B. Mills, Warren R. Francis, Sergio Vargas, Morten Larsen, Coen P.H. Elemans, Donald E. Canfield, Gert Wörheide: The last common ancestor of animals lacked the HIF pathway and respired in low-oxygen environments. In: eLife. Band 7, 2018, Artikel Nr. 31176, doi:10.7554/eLife.31176, S. 6.
- ↑ Daniel B. Mills, Warren R. Francis, Sergio Vargas, Morten Larsen, Coen P.H. Elemans, Donald E. Canfield, Gert Wörheide: The last common ancestor of animals lacked the HIF pathway and respired in low-oxygen environments. In: eLife. Band 7, 2018, Artikel Nr. 31176, doi:10.7554/eLife.31176, S. 4.
- ↑ Louis F. Ungemach, Kerry Souza, Paul E. Fell, Stephen H. Loomis: Possession and Loss of Cold Tolerance by Sponge Gemmules: A Comparative Study. In: Invertebrate Biology. Band 116, 1997, doi:10.2307/3226918, S. 1.
- ↑ Huw J. Griffiths, Paul Anker, Katrin Linse, Jamie Maxwell, Alexandra L. Post, Craig Stevens, Slawek Tulaczyk, James A. Smith: Breaking All the Rules: The First Recorded Hard Substrate Sessile Benthic Community Far Beneath an Antarctic Ice Shelf. In: Frontiers in Marine Science. Band 8, 2021, doi:10.3389/fmars.2021.642040, S. 6
- ↑ Gordon D. Love, Emmanuelle Grosjean, Charlotte Stalvies, David A. Fike, John P. Grotzinger, Alexander S. Bradley, Amy E. Kelly, Maya Bhatia, William Meredith, Colin E. Snape, Samuel A. Bowring, Daniel J. Condon, Roger E. Summons: Fossil steroids record the appearance of Demospongiae during the Cryogenian period. In: Nature. Band 457, 2009, doi:10.1038/nature07673, S. 718.
- ↑ J. Alex Zumberge, Gordon D. Love, Paco Cárdenas, Erik A. Sperling, Sunithi Gunasekera, Megan Rohrssen, Emmanuelle Grosjean, John P. Grotzinger, Roger E. Summons: Demosponge steroid biomarker 26-methylstigmastane provides evidence for Neoproterozoic animals. In: Nature Ecology & Evolution. Band 2, 2018, doi:10.1038/s41559-018-0676-2, S. 1709.
- ↑ Benjamin J. Nettersheim, Jochen J. Brocks, Arne Schwelm, Janet M. Hope, Fabrice Not, Michael Lomas, Christiane Schmidt, Ralf Schiebel, Eva C. M. Nowack, Patrick De Deckker, Jan Pawlowski, Samuel S. Bowser, Ilya Bobrovskiy, Karin Zonneveld, Michal Kucera, Marleen Stuhr, Christian Hallmann: Putative sponge biomarkers in unicellular Rhizaria question an early rise of animals. In: Nature Ecology & Evolution. Band 3, 2019, doi:10.1038/s41559-019-0806-5, S. 577.
- ↑ Ilya Bobrovskiy, Janet M. Hope, Benjamin J. Nettersheim, John K. Volkman, Christian Hallmann, Jochen J. Brocks: Algal origin of sponge sterane biomarkers negates the oldest evidence for animals in the rock record. In: Nature Ecology & Evolution. Brief Communications, 23. November 2020, doi:10.1038/s41559-020-01334-7.
- ↑ Lennart M. van Maldegem, Benjamin J. Nettersheim, Arne Leider, Jochen J. Brocks, Pierre Adam, Philippe Schaeffer, Christian Hallmann: Geological alteration of Precambrian steroids mimics early animal signatures. In: Nature Ecology & Evolution. Brief Communications, 23. November 2020, doi:10.1038/s41559-020-01336-5.
- ↑ Philip A. Allen, James L. Etienne: Sedimentary challenge to Snowball Earth. In: Nature Geoscience. Band 1, 2008, doi:10.1038/ngeo355, S. 817, 819, 824.
- ↑ John A. Cunningham, Kelly Vargas, Zongjun Yin, Stefan Bengtson, Philip C. J. Donoghue: The Weng’an Biota (Doushantuo Formation): an Ediacaran window on soft-bodied and multicellular microorganisms. In: Journal of the Geological Society. Band 174, 2017, doi:10.1144/jgs2016-142, S. 793–794.
- ↑ Shuhai Xiao, Xunlai Yuan, Andrew H. Knoll: Eumetazoan fossils in terminal Proterozoic phosphorites? In: PNAS. Band 97, 2000, doi:10.1073/pnas.250491697, S. 13684.
- ↑ Jake V. Bailey, Samantha B. Joye, Karen M. Kalanetra, Beverly E. Flood, Frank A. Corsetti: Evidence of giant sulphur bacteria in Neoproterozoic phosphorites. In: Nature. Band 445, 2007, doi:10.1038/nature05457, S. 198.
- ↑ Shuhai Xiao, A.D. Muscente, Lei Chen, Chuanming Zhou, James D. Schiffbauer, Andrew D. Wood, Nicholas F. Polys, Xunlai Yuan: The Weng'an biota and the Ediacaran radiation of multicellular eukaryotes. In: National Science Review, Band 1, 2014, doi:10.1093/nsr/nwu061, S. 498.
- ↑ Zongjun Yin, Kelly Vargas, John Cunningham, Stefan Bengtson, Maoyan Zhu, Federica Marone, Philip Donoghue: The Early Ediacaran Caveasphaera Foreshadows the Evolutionary Origin of Animal-like Embryology. In: Current Biology. Band 29, 2019, doi:10.1016/j.cub.2019.10.057, S. 4307.
- ↑ John A. Cunningham, Kelly Vargas, Zongjun Yin, Stefan Bengtson, Philip C. J. Donoghue: The Weng’an Biota (Doushantuo Formation): an Ediacaran window on soft-bodied and multicellular microorganisms. In: Journal of the Geological Society. Band 174, 2017, doi:10.1144/jgs2016-142, S. 798–799.
- ↑ Zongjun Yin, Kelly Vargas, John Cunningham, Stefan Bengtson, Maoyan Zhu, Federica Marone, Philip Donoghue: The Early Ediacaran Caveasphaera Foreshadows the Evolutionary Origin of Animal-like Embryology. In: Current Biology. Band 29, 2019, doi:10.1016/j.cub.2019.10.057, S. 4310, 4312.
- ↑ vergleiche Nagayasu Nakanishi, Shunsuke Sogab, Bernard M. Degnan: Evolutionary origin of gastrulation: insights from sponge development. In: BMC Biology. Band 12, 2014, Artikel Nr. 26, doi:10.1186/1741-7007-12-26, S. 5–6.
- ↑ Zongjun Yin, Kelly Vargas, John Cunningham, Stefan Bengtson, Maoyan Zhu, Federica Marone, Philip C.J. Donoghue: The Early Ediacaran Caveasphaera Foreshadows the Evolutionary Origin of Animal-like Embryology. In: Current Biology. Band 29, 2019, doi:10.1016/j.cub.2019.10.057, S. 4309.
- ↑ Zongjun Yin, Weichen Sun, Pengju Liu, Maoyan Zhu, Philip C.J. Donoghue: Developmental biology of Helicoforamina reveals holozoan affinity, cryptic diversity, and adaptation to heterogeneous environments in the early Ediacaran Weng’an biota (Doushantuo Formation, South China). In: Science Advances. Band 6, 2020, doi:10.1126/sciadv.abb0083, Artikel Nr. eabb0083, S. 4–5.
- ↑ Zongjun Yin, Weichen Sun, Joachim Reitner and Maoyan Zhu: New holozoans with cellular resolution from the early Ediacaran Weng’an Biota, SW China. In: Journal of the Geological Society. Band 179, 2022, doi:10.1144/jgs2021-061, Artikel Nr. jgs2021-061, S. 8.
- ↑ Zongjun Yin, Maoyan Zhu, Eric H. Davidson, David J. Bottjer, Fangchen Zhao, Paul Tafforeau: Sponge grade body fossil with cellular resolution dating 60 Myr before the Cambrian. In: PNAS. Band 112, 2015, doi:10.1073/pnas.1414577112, S. E1454–E1455.
- ↑ Zongjun Yin, Maoyan Zhu, Eric H. Davidson, David J. Bottjer, Fangchen Zhao, Paul Tafforeau: Sponge grade body fossil with cellular resolution dating 60 Myr before the Cambrian. In: PNAS. Band 112, 2015, doi:10.1073/pnas.1414577112, S. E1457–E1458.
- ↑ John A. Cunningham, Kelly Vargas, Zongjun Yin, Stefan Bengtson, Philip C. J. Donoghue: The Weng’an Biota (Doushantuo Formation): an Ediacaran window on soft-bodied and multicellular microorganisms. In: Journal of the Geological Society. Band 174, 2017, doi:10.1144/jgs2016-142, S. 799.
- ↑ Heda Agić, Anette E.S. Högström, Małgorzata Moczydłowska, Sören Jensen, Teodoro Palacios, Guido Meinhold, Jan Ove R. Ebbestad, Wendy L. Taylor, Magne Høyberget: Organically-preserved multicellular eukaryote from the early Ediacaran Nyborg Formation, Arctic Norway. In: Scientific Reports. Band 9, Artikel Nr. 14659, doi:10.1038/s41598-019-50650-x, S. 8.
- ↑ Chia-Wei Li, Jun-Yuan Chen, Tzu-En Hua: Precambrian Sponges with Cellular Structures. In: Science. Band 279, 1998, doi:10.1126/science.279.5352.879, S. 879.
- ↑ Jonathan B. Antcliffe, Richard H. T. Callow, Martin D. Brasier: Giving the early fossil record of sponges a squeeze. In: Biological Reviews. Band 89, 2014, doi:10.1111/brv.12090, S. 984 (S. 13).
- ↑ Joseph P. Botting, Lucy A. Muir: Early sponge evolution: A review and phylogenetic framework. In: Palaeoworld. Band 27, 2018, doi:10.1016/j.palwor.2017.07.001, S. 1.
- ↑ Qing Tang, Bin Wan, Xunlai Yuan, A.D. Muscente, Shuhai Xiao: Spiculogenesis and biomineralization in early sponge animals. In: Nature Communications. Band 10, 2019, Artikel Nr. 3348, doi:10.1038/s41467-019-11297-4, S. 2, 6–7, 9.
- ↑ a b Shan Chang, Lei Zhang, Sébastien Clausen, David J. Bottjer, Qinglai Feng: The Ediacaran-Cambrian rise of siliceous sponges and development of modern oceanic ecosystems. In: Precambrian Research. Band 333, 2019, Artikel Nr. 105438, doi:10.1016/j.precamres.2019.105438, S. 1.
- ↑ Xiaopeng Wang, Alexander G. Liu, Zhe Chen, Chengxi Wu, Yarong Liu, Bin Wan, Ke Pang, Chuanming Zhou, Xunlai Yuan, Shuhai Xiao: A late-Ediacaran crown-group sponge animal. In: Nature. Band 630, 2024, doi:10.1038/s41586-024-07520-y, S. 905–911.
- ↑ Jonathan B. Antcliffe, Richard H. T. Callow, Martin D. Brasier: Giving the early fossil record of sponges a squeeze. In: Biological Reviews. Band 89, 2014, doi:10.1111/brv.12090, S. 974 (S. 3).
- ↑ Thomas Cavalier-Smith: Origin of animal multicellularity: precursors, causes, consequences — the choanoflagellate/sponge transition, neurogenesis and the Cambrian explosion. In: Philosophical Transactions of the Royal Society B. Band 372, 2017, doi:10.1098/rstb.2015.0476, Artikel Nr. 20150476, S. 7.
- ↑ Bernd Schierwater, Michael Eitel, Wolfgang Jakob, Hans-Jürgen Osigus, Heike Hadrys, Stephen L. Dellaporta, Sergios-Orestis Kolokotronis, Rob DeSalle: Concatenated Analysis Sheds Light on Early Metazoan Evolution and Fuels a Modern "Urmetazoon" Hypothesis. In: PLoS Biology. Band 7, 2009, Artikel Nr. e1000020, doi:10.1371/journal.pbio.1000020, S. 40–42.
- ↑ Claus Nielsen Life cycle evolution: was the eumetazoan ancestor a holopelagic, planktotrophic gastraea?. In: BMC Evolutionary Biology. Band 13, 2013, Artikel Nr. 171, doi:10.1186/1471-2148-13-171, S. 14–15.
- ↑ Claus Nielsen: Early animal evolution: A morphologist's view. In: Royal Society Open Science. Band 6, 2019, Artikel Nr. 190638, doi:10.1098/rsos.190638, S. 4, 6.
- ↑ Shuhai Xiao, Xunlai Yuan, Andrew H. Knoll: Eumetazoan fossils in terminal Proterozoic phosphorites? In: PNAS. Band 97, 2000, doi:10.1073/pnas.250491697, S. 13687–13688.
- ↑ John A. Cunningham, Kelly Vargas, Liu Pengju, Veneta Belivanova, Federica Marone, Carlos Martínez-Pérez, Manuel Guizar-Sicairos, Mirko Holler, Stefan Bengtson, Philip C. J. Donoghue: Critical appraisal of tubular putative metazoans from the Ediacaran Weng’an Dushantuo biota. In: Proceedings of the Royal Society of London • Series B. Band 282. 2015, doi:10.1098/rspb.2015.1169, S. 7–8.
- ↑ Alexander G. Liu, Jack J. Matthews, Latha R. Menon, Duncan McIlroy and Martin D. Brasier: Haootia quadriformis n. gen., n. sp., interpreted as a muscular cnidarian impression from the Late Ediacaran period (approx. 560 Ma). In: Proceedings of the Royal Society of London • Series B. Band 281, 2014, doi:10.1098/rspb.2014.1202, S. 1–7.
- ↑ Scott D. Evans, Ian V. Hughes, James G. Gehling, and Mary L. Droser: Discovery of the oldest bilaterian from the Ediacaran of South Australia. In: PNAS. Band 117, 2020, doi:10.1073/pnas.2001045117, S. 7845.
- ↑ Shuhai Xiao, Marc Laflamme: On the eve of animal radiation: phylogeny, ecology and evolution of the Ediacara biota. In: Trends in Ecology and Evolution. Band 24, 2009, doi:10.1016/j.tree.2008.07.015, S. 34.
- ↑ Graham E. Budd, Maximilian J. Telford: The origin and evolution of arthropods. In: Nature. Band 457, 2009, doi:10.1038/nature07890, S. 814.
- ↑ Mikhail A. Fedonkin, Benjamin M Waggoner: The Late Precambrian fossil Kimberella is a mollusc-like bilaterian organism. In: Nature. Band 388, 1997, S. 869.
- ↑ Ilya Bobrovskiy, Janet M. Hope, Andrey Ivantsov, Benjamin J. Nettersheim, Christian Hallmann, Jochen J. Brocks: Ancient steroids establish the Ediacaran fossil Dickinsonia as one of the earliest animals. In: Science, Band 361, 2018, doi:10.1126/science.aat7228, S. 1248.
- ↑ John A. Cunningham, Alexander G. Liu, Stefan Bengtson, Philip C. J. Donoghue: The origin of animals: Can molecular clocks and the fossil record be reconciled? In: BioEssays. Band 39, 2016, doi:10.1002/bies.201600120, S. 5.
- ↑ James D. Schiffbauer, Tara Selly, Sarah M. Jacquet, Rachel A. Merz, Lyle L. Nelson, Michael A. Strange, Yaoping Cai, Emily F. Smith: Discovery of bilaterian-type through-guts in cloudinomorphs from the terminal Ediacaran Period. In: Nature Communications. Band 11, 2020, Artikel-Nr. 205, S. 9.
- ↑ Zhe Chen, Chuanming Zhou, Xunlai Yuan, Shuhai Xiao: Death march of a segmented and trilobate bilaterian elucidates early animal evolution. In: Nature. Band 573, 2019, S. 412.
- ↑ Amy J. Shore, Rachel A. Wood, Ian B. Butler, Andrey Yu. Zhuravlev, Sean McMahon, Alexandra Curtis, Fred T. Bowyer: Ediacaran metazoan reveals lophotrochozoan affinity and deepens root of Cambrian Explosion. In: Science Advances. Band 7, 2021, Artikel Nr. eabf2933, doi:10.1126/sciadv.abf2933, S. 1.
- ↑ Roger E. Summons, Douglas H. Erwin: Chemical clues to the earliest animal fossils. In: Science. Band 361, 2018, doi:10.1126/science.aau9710, S. 1198–1199.
- ↑ Erik A. Sperling, Jakob Vinther: A placozoan affinity for Dickinsonia and the evolution of the late Proterozoic metazoan feeding modes. In: Evolution and Development. Band 12, 2010, doi:10.1111/j.1525-142X.2010.00404.x, S. 201.
- ↑ Ziyi Zhu, Ian H. Campbell, Charlotte M. Allen, Jochen J. Brocks, Bei Chen: The temporal distribution of Earth's supermountains and their potential link to the rise of atmospheric oxygen and biological evolution. In: Earth and Planetary Science Letters. Band 580, Artikel Nr. 117391, doi:10.1016/j.epsl.2022.117391, S. 1.
- ↑ Richard J. Squire, Ian H. Campbell, Charlotte M. Allen, Christopher J. L. Wilson: Did the Transgondwanan Supermountain trigger the explosive radiation of animals on Earth?. In: Earth and Planetary Science Letters. Band 250, 2006, doi:10.1016/j.epsl.2006.07.032, S. 116.
- ↑ a b Joshua J. Williams, Benjamin J. W. Mills, Timothy M. Lenton: A tectonically driven Ediacaran oxygenation event. In: Nature Communications. Band 10, 2019, Artikel Nr. 2690, doi:10.1038/s41467-019-10286-x, S. 1.
- ↑ Feifei Zhang, Shuhai Xiao, Brian Kendall, Stephen J. Romaniello, Huan Cui, Mike Meyer, Geoffrey J. Gilleaudeau, Alan J. Kaufman, Ariel D. Anbar: Extensive marine anoxia during the terminal Ediacaran Period. In: Science Advances. Band 4, 2018, Artikel Nr. eaan8983, doi:10.1126/sciadv.aan8983, S. 1, 7.
- ↑ Scott D. Evans, Chenyi Tu, Adriana Rizzo, Rachel L. Surprenant, Phillip C. Boan, Heather McCandless, Nathan Marshall, Shuhai Xiao, Mary L. Droser: Environmental drivers of the first major animal extinction across the Ediacaran White Sea-Nama transition. In: PNAS. Band 119, 2022, doi:10.1073/pnas.2207475119, Artikel Nr. e2207475119, S. 1.
- ↑ Wentao Huang, John A. Tarduno, Tinghong Zhou, Mauricio Ibañez-Mejia, Laércio Dal Olmo-Barbosa, Edinei Koester, Eric G. Blackman, Aleksey V. Smirnov, Gabriel Ahrendt, Rory D. Cottrell, Kenneth P. Kodama, Richard K. Bono, David G. Sibeck, Yong-Xiang Li, Francis Nimmo, Shuhai Xiao, Michael K. Watkeys: Near-collapse of the geomagnetic field may have contributed to atmospheric oxygenation and animal radiation in the Ediacaran Period. In: Communications Earth & Environment. Band 5, 2024, , S. 1–8.
- ↑ Tianchen He, Maoyan Zhu, Benjamin J. W. Mills, Peter M. Wynn, Andrey Yu. Zhuravlev, Rosalie Tostevin, Philip A. E. Pogge von Strandmann, Aihua Yang, Simon W. Poulton, Graham A. Shields: Possible links between extreme oxygen perturbations and the Cambrian radiation of animals. In: Nature Geoscience. Band 12, 2019, S. 468.
- ↑ Xingliang Zhang, Degan Shu: Current understanding on the Cambrian Explosion: questions and answers. In: Paläontologische Zeitschrift. Band 95, 2021, doi:10.1007/s12542-021-00568-5, S. 648, 650–651.
- ↑ Jens Boenigk, Sabina Wodniok: Biodiversität und Erdgeschichte. Springer-Verlag, Berlin/Heidelberg 2014, ISBN 978-3642553882, S. 104.
Auf dieser Seite verwendete Medien
Autor/Urheber:
Dreisam. Original authors: Núria Ros-Rocher, Alberto Pérez-Posada, Michelle M. Leger, Iñaki Ruiz-Trillo.
The parent image was uploaded by User:Jtwsaddress42. Jtwsaddress42 had taken it from a certain scientific paper, cited above.
That paper was published by the Royal Society under the terms of the Creative Commons Attribution License https://creativecommons.org/licenses/by/4.0/, which permits unrestricted use, provided the original author and source are credited., Lizenz: CC BY-SA 4.0Temporally alternating life cycles of unicellular holozoans. Life stages of the colonial choanoflagellate Salpingoeca rosetta. The asexual life cycle (on the right) includes a single-celled sessile thecate stage (adhered to the substrate), slow and fast swimming single-celled stages, and two types of clonal colonial stages (chain and rosette colonies), in which neighbouring cells are linked by intercellular bridges. Starvation triggers the S. rosetta sexual cycle (on the left), in which diploid cells (slow swimmers) undergo meiosis and recombination, and the resulting haploid cells (which can also divide asexually) mate anisogamously.
Autor/Urheber: James St. John, Lizenz: CC BY 2.0
Tillite in the Precambrian of South Australia.
Tillite is a lithified till, a poorly-sorted, coarse-grained, non-bedded glacial deposit. Tills form as either continental glaciers or alpine glaciers advance and retreat. The glacial debris seen here was reworked by fluvial action, so they are actually glaciofluvial deposits.
This reddish tillite is part of South Australia's Elatina Formation and formed about 640 million years ago, during the Marinoan Glaciation. The Marinoan was one of two or three global or near-global ice ages called "Snowball Earth Glaciations". Laterally, along strike, the Elatina Formation has tidalites (see elsewhere in this photo album), which only form at sea level. Paleomagnetic analysis shows that this area was within 5° of latitude of the paleoequator. In other words, glaciers were present at sea level at the equator. That can only happen during an extreme ice age. Stratigraphic evidence from sites around the globe also indicate a widespread ice age.
Snowball Earth events were the most significant ice ages ever. The most extreme models describing Snowball Earth have glacial ice completely covering all continents and all oceans, even at the equator. Some models, called “Slushball Earth”, have Earth’s equatorial oceanic areas not completely frozen over. Each Snowball Earth Glaciation was followed by a super-greenhouse climate. The resulting sedimentary record of these “freeze-fry” events typically consists of glacial tillites and overlying cap carbonates. These units are preserved at many localities on Earth, including the section seen here.
In this area, the reddish tillite unit is about 300 meters thick and has an conformably-overlying cap carbonate. The tillite has clasts with glacial striations.
Stratigraphy: Elatina Formation, Marinoan, ~uppermost Cryogenian, top of the middle Neoproterozoic
Locality: outcrop along Enorama Creek, Brachina Gorge Geologic Trail, Flinders Ranges National Park, South Australia (vicinity of 31° 19.892’ South latitude, 138° 38.001’ East longitude)
See info. at: en.wikipedia.org/wiki/Marinoan_glaciation and
en.wikipedia.org/wiki/Snowball_EarthAutor/Urheber: Ya Gao, Daisylyn Senna Tan, Mathias Girbig, Haoqing Hu, Xiaomin Zhou, Qianwen Xie, Shi Wing Yeung, Kin Shing Lee, Sik Yin Ho, Vlad Cojocaru, Jian Yan, Georg K. A. Hochberg, Alex de Mendoza, Ralf Jauch (croped, digitally enhanced, "Choanozoa" & "Filozoa" added), Lizenz: CC BY-SA 4.0
Phylogeny of holozoans (acording to Teretosporea hypothesis)
Autor/Urheber: Dreisam, Lizenz: CC BY-SA 4.0
Sources
- Jonathan B. Antcliffe, Richard H. T. Callow, Martin D. Brasier: Giving the early fossil record of sponges a squeeze. In: Biological Reviews. Volume 89, 2014, doi:10.1111/brv.12090, p. 973.
- Thomas Cavalier-Smith: Origin of animal multicellularity: precursors, causes, consequences — the choanoflagellate/sponge transition, neurogenesis and the Cambrian explosion. In: Philosophical Transactions of the Royal Society B. Volume 372, 2017, doi:10.1098/rstb.2015.0476, p. 2–4.
- Thibaut Brunet, Nicole King: The Origin of Animal Multicellularity and Cell Differentiation. In: Developmental Cell. Volume 43, 2017, doi:10.1016/j.devcel.2017.09.016, p. 125.
- Martin Dohrmann, Gert Wörheide: Novel Scenarios of Early Animal Evolution—Is It Time to Rewrite Textbooks?. In: Integrative and Comparative Biology. Volume 53, 2013, doi:10.1093/icb/ict008, p. 504.
- Gert Wörheide, Martin Dohrmann, Dirk Erpenbeck, Claire Larroux, Manuel Maldonado, Oliver Voigt, Carole Borchiellini, Dennis V. Lavrov: Deep Phylogeny and Evolution of Sponges (Phylum Porifera). In: Advances in Marine Biology. Volume 61, 2012, doi:10.1016/B978-0-12-387787-1.00007-6, p. 1.
Autor/Urheber: Mark J. Dayel, Lizenz: CC BY-SA 3.0
Salpingoeca rosetta single cell
Autor/Urheber: Mark J. Dayel, Lizenz: CC BY-SA 3.0
Salpingoeca rosetta colonies
Autor/Urheber: John A. Cunningham, Kelly Vargas, Zongjun Yin, Stefan Bengtson and Philip C. J. Donoghue, Lizenz: CC BY 3.0
Scanning electron microscope images of fossils from the Weng'an biota. (a–f) Tianzhushania specimens at various stages of division from a single cell (a) to many hundreds of cells (f) Swedish Museum of Natural History (SMNH) X 6449–SMNH X 6454. (g) Helicoforamina SMNH X 6455. (h) Spiralicellula (from Tang et al. 2008). (i) Caveasphaera SMNH X 6456. (j) Archaeophycus, a putative red alga SMNH X 6457. (k) Mengeosphaera, an acritarch SMNH X 6458. (l) Eocyathispongia, a putative sponge, Nanjing Institute of Palaeontology and Geology (NIGPAS) 161760 (from Yin et al. 2015). Scale bar: (a) 320 µm, (b) 265 µm, (c) 265 µm, (d) 200 µm, (e) 245 µm, (f) 280 µm, (g) 395 µm, (h) 380 µm, (i) 250 µm, (j) 255 µm, (k) 130 µm, (l) 415 µm.
Autor/Urheber: James St. John, Lizenz: CC BY 2.0
Dickinsonia costata Sprigg, 1947 in quartzose sandstone from the Precambrian of Australia. (SAM P41125, South Australian Museum, Adelaide, Australia) (~7.2 cm long)
Soft-bodied macroscopic fossils have long been known from upper Neoproterozoic (Ediacaran) rocks, but they continue to generate much excitement among geologists. Biologic interpretations of Ediacaran organisms have been all over the map. Many Ediacaran fossils appear to be animals, but some paleontologists have interpreted them as lichens or giant protists or members of an extinct kingdom.
One of the quintessential examples of an Ediacaran fossil is Dickinsonia. Prima facie, it appears bilaterally symmetrical, but it does have subtle asymmetry. It has the general appearance of a flattened worm with a stretched pancake body. This Dickinsonia specimen is from the Flinders Ranges of South Australia, one of the world’s classic localities for Ediacaran fossils. As do most Ediacarans, Dickinsonia displays soft-part preservation in a matrix of clean, quartzose sandstone.
Stratigraphy: Ediacara Member, Rawnsley Quartzite, near-uppermost Neoproterozoic
Locality: Flinders Ranges, South AustraliaAutor/Urheber: Philcha, Lizenz: CC BY-SA 3.0
Porifera body structure, for use with annotated image. Colour-coding:
- Yellow: pinacocytes
- Red: choanocytes
- Grey: mesohyl
- Pale blue: water flow
Structure types:
- Left: asconoid
- Middle: syconoid
- Right: leuconoid










