Stereozentrum

Als Stereozentrum (auch Chiralitätszentrum oder stereogenes Zentrum/Atom) bezeichnet man in der Stereochemie einen Punkt in einem Molekül mit einem Satz an Substituenten in einer solchen räumlichen Anordnung, dass sie mit der spiegelbildlichen Anordnung nicht in Deckung gebracht werden kann.[1][2]
- Zwei diastereomere Enantiomerenpaare am Beispiel des 2-Brom-4-methylhexans.[3] Zusätzliche Stereozentren würden zusätzliche Enantiomerenpaare erzeugen.
- Enantiomere und Diastereomere am Beispiel von Epoxiden: Enantiomere sind Spiegelbilder zueinander, Diastereomere nicht.
Das Stereozentrum muss nicht unbedingt mit einem Atom zusammenfallen, sondern kann auch zwischen mehreren Atomen liegen (s. u.: Doppelbindung).
Formen
Eine gängige Form des Stereozentrums ist das asymmetrisch substituierte Kohlenstoffatom, das vier unterschiedliche Substituenten trägt, z. B. ein Wasserstoffatom (H), einen Methylrest (CH3), einen Ethylrest (CH2CH3) und einen Propylrest (CH2CH2CH3). In diesem Zusammenhang wird auch häufig die formal nicht ganz korrekte Bezeichnung des asymmetrischen Kohlenstoffatoms verwendet. Der Begriff ist jedoch historisch geprägt und geht auf Jacobus Henricus van ’t Hoff zurück.[4]
Der Begriff Substituent ist dabei weit zu fassen und beinhaltet auch freie Elektronenpaare. Daher können nicht nur vierbindige, tetraedrisch koordinierte Kohlenstoffatome oder quartäre Ammoniumverbindungen vom Amin-Typ Chiralitätszentren sein, sondern auch pyramidal koordinierte Atome wie z. B. Stickstoffatome in sterisch gehinderten Aminen, Phosphoratome in Phosphanen oder Schwefelatome in Sulfoxiden.
Auch eine Doppelbindung kann ein Stereozentrum darstellen, sie wird dann als stereogene Doppelbindung bezeichnet.[5] Nach der Cahn-Ingold-Prelog-Konvention werden die beiden resultierenden Stereoisomere gekennzeichnet mit (E) (von Entgegen) oder mit (Z) (von Zusammen).[6]
Zur Kennzeichnung eines Stereozentrums in Strukturformeln wird für gewöhnlich ein Stern verwendet. Diese Kennzeichnung wird jedoch seitens der IUPAC nicht empfohlen, sofern die Bedeutung des Sterns nicht eindeutig aus dem gegebenen Kontext hervorgeht.[7] Die Nomenklatur der Konfiguration eines Stereozentrums erfolgt mit Hilfe der Cahn-Ingold-Prelog-Konvention.
Während ein einzelnes Stereozentrum immer ein chirales Molekül bedingt, führt das Vorhandensein mehrerer Stereozentren nicht zwangsläufig zu einer chiralen Struktur. Existieren nämlich mehrere zueinander spiegelbildliche Stereozentren innerhalb des Moleküls, so liegt eine achirale meso-Verbindung vor.
Umgekehrt gibt es auch chirale Verbindungen ohne Chiralitätszentrum, die dann eine axiale, helicale oder planare Chiralität aufweisen.
Von Verbindungen mit Stereozentren existieren Stereoisomere. Sind Stereoisomere spiegelbildlich zueinander, so spricht man von Enantiomeren, andernfalls von Diastereomeren.
Stereozentren können in chemischen Reaktionen entweder gezielt (Stereospezifität) oder bevorzugt (Stereoselektivität) gebildet werden. Reaktionen, bei denen die möglichen Konfigurationen eines Stereozentrums gleich häufig gebildet werden, bezeichnet man als stereounspezifisch.
Anzahl
Die Zahl der maximal möglichen Stereoisomere eines Moleküls lässt sich aus der Zahl seiner Stereozentren berechnen:
- Ein Molekül mit n Stereozentren besitzt 2n Stereoisomere. Die 2n Stereoisomere bilden 2n-1 Enantiomer-Paare, die zueinander diastereomer sind.
Die rechts gezeigte Struktur von 2-Brom-4-methylhexan (n = 2 Stereozentren) besitzt also 22 = 4 verschiedene Stereoisomere. Diese bilden 22-1 = 2 Enantiomer-Paare, die zueinander diastereomer sind.[6]
Die tatsächliche Zahl der Stereozentren kann niedriger sein, beispielsweise durch meso-Verbindungen oder durch Verknüpfungen der Stereozentren untereinander, wie bei Heterocyclen möglich.
Einzelnachweise
- ↑ Eintrag zu chirality centre. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C01060 – Version: 2.1.5.
- ↑ Karl-Heinz Hellwich: Stereochemie: Grundbegriffe. Springer-Verlag, Heidelberg, Berlin 2002, ISBN 3-540-42347-8, S. 21.
- ↑ Gerhard Hilt, Peter Rinze: Chemisches Praktikum für Mediziner. Springer, 2012, ISBN 978-3-8348-0667-3 (Seite 153 in der Google-Buchsuche).
- ↑ Peter J. Ramberg: Chemical Structure, Spatial Arrangement: The Early History of Stereochemistry, 1874-1914. Ashgate Publishing, Aldershot 2003, ISBN 0-7546-0397-0, S. 57 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ursula Bünzli-Trepp: Systematic Nomenclature of Organic, Organometallic and Coordination Chemistry: Chemical Abstracts Guidelines and Iupac Recommendations and Many Trivial Names. EPFL Press, 2007, ISBN 978-1-4200-4615-1 (Seite 560 in der Google-Buchsuche).
- ↑ a b Paula Yurkanis Bruice: Organische Chemie: Studieren kompakt. Pearson Deutschland GmbH, 2011, ISBN 978-3-86894-103-6 (Seite 131 in der Google-Buchsuche).
- ↑ Jonathan Brecher: Graphical representation standards for chemical structure diagrams (IUPAC Recommendations 2008). In: Pure Appl. Chem. Band 80, Nr. 2, 2008, S. 277–410, doi:10.1351/pac200880020277.
Auf dieser Seite verwendete Medien
1_Stereocenter_Structural_Formulae
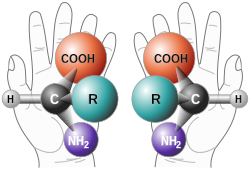
Amino Acid Chirality chirality with hands from http://www.nai.arc.nasa.gov/ A "chiral" molecule is one that is not superposable with its mirror image. Like left and right hands that have a thumb, fingers in the same order, but are mirror images and not the same, chiral molecules have the same things attached in the same order, but are mirror images and not the same. Although most amino acids can exist in both left and right handed forms, Life on Earth is made of left handed amino acids, almost exclusively. No one knows why this is the case. However, Drs. John Cronin and Sandra Pizzarello have shown that some of the amino acids that fall to earth from space are more left than right. Thus, the fact that we are made of L amino acids may be because of amino acids from space. Why do amino acids in space favor L? No one really knows, but it is known that radiation can also exist in left and right handed forms. So, there is a theory called the Bonner hypothesis, that proposes that left handed radiation in space (from a rotating neutron star for example) could lead to left handed amino acids in space, which would explain the left handed amino acids in meteorites. This is still speculative but our paper makes it much more plausible. In fact, this observations was one of the main reasons why we pursued this research. Although there were theories about how the amino acids could form in space in the ice, no one had shown that it was viable to make amino acids this way, until now.
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
enantiomers and diastereomers explained by epoxides
2_Stereocenters_Structural_Formulae
Autor/Urheber: Minihaa, Lizenz: CC BY-SA 3.0
Zwei diastereomere Enantiomerenpaare


![Zwei diastereomere Enantiomerenpaare am Beispiel des 2-Brom-4-methylhexans.[3] Zusätzliche Stereozentren würden zusätzliche Enantiomerenpaare erzeugen.](http://upload.wikimedia.org/wikipedia/commons/thumb/3/30/Stereozentrenpaare.svg/400px-Stereozentrenpaare.svg.png)