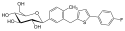
Canagliflozin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
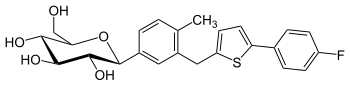 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Canagliflozin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C24H25FO5S | |||||||||||||||||||||
| Kurzbeschreibung | weißer bis gelblicher Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | A10BX11 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | SGLT-2-Inhibitor | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 444,52 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||||||||
| Schmelzpunkt | 68–72 °C[1] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Canagliflozin ist ein orales Antidiabetikum zur Behandlung des Diabetes mellitus Typ 2. Es wurde von Janssen-Cilag International NV entwickelt.
Pharmakologie
Wirkmechanismus
Canagliflozin ist ein selektiver SGLT-2-Inhibitor. Die Glucose, welche durch den Glomerulus abfiltriert wird, wird zu 99 % rückresorbiert. Daran beteiligt sind die Transportproteine SGLT1 und SGLT 2, welche im proximalen Tubulus Glucose zusammen mit Natrium aus dem Primärharn in die Tubuluszellen transportieren. Treibende Kraft hierfür ist das Natrium-Konzentrationsgefälle, welches durch die Na+/K+-APTase aufrechterhalten wird. Bei SGLT1 handelt es sich um einen Cotransporter mit geringer Kapazität aber hoher Affinität, bei SGLT2 ist die Kapazität hoch aber die Affinität gering. Unter Behandlung mit Canagliflozin kommt es daher nur selten zu Hypoglykämien, da SGLT2 unter euglykämischen Bedingungen nur 50 % seiner Kapazität ausschöpft. Unter eu- und hypoglykämischen Bedingungen verfügt SGLT1 über eine höhere Kapazität als SGLT2 und kann somit eine Inhibition von SGLT2 kompensieren.[3][4]
Pharmakokinetik
Maximale Plasmaspiegel erreicht Canagliflozin 1–2 Stunden nach peroraler Einnahme, steady state Plasmaspiegel nach 4–5 Tagen. Die Bioverfügbarkeit liegt bei 65 %, die Plasmaproteinbindung bei 99 %, wobei es hauptsächlich an Albumin gebunden vorliegt. Canagliflozin muss nur einmal täglich eingenommen werden, da es den renalen Schwellenwert der Glucosereabsorption für 24 Stunden senkt. Die Halbwertszeit beträgt bei einer Dosis von 100 mg 10,6 Stunden, bei einer Dosis von 300 mg 13,1 Stunden. Metabolisiert wird Canagliflozin hauptsächlich durch eine O-Glucuronidierung über die Uridin-Diphosphat-Glucuronosyltransferase 1A9 (UGT1A9) und die UGTB4. Hierbei entstehen inaktive Metaboliten, die zu 33 % renal eliminiert und zu 42 % über die Faeces abgegeben werden. Es unterliegt nur einem minimalen Cytochrom P450-Metabolismus, wodurch es nur geringes Wechselwirkungspotential mit anderen Wirkstoffen aufweist.[5]
Unerwünschte Arzneimittelwirkungen
Zu den häufigsten unerwünschten Arzneimittelwirkungen bei Canagliflozin gehören sowohl ein erhöhtes Risiko für Harnwegsinfektionen als auch für Pilzinfektionen im Genitalbereich aufgrund der hohen Glucosekonzentration im Urin.[6] Seltener kommt es durch die osmotische Diurese zu Kopfschmerzen, orthostatischer Hypotension, Schwindel, erhöhtem Harndrang und Diarrhoe.[7] Eine im Juni 2017 veröffentlichte Studie im New England Journal of Medicine ergab Hinweise auf ein signifikant erhöhtes Risiko von Zeh- und Mittelfußamputationen im Vergleich zu Placebo.[8][9]
Zulassungsstatus
Im November 2013 erhielt Canagliflozin unter dem Namen INVOKANA die Zulassung von der Europäischen Arzneimittel-Agentur EMA. Die Indikation umfasste Patienten mit Typ-2-Diabetes im Alter von mehr als 18 Jahren:
- als Monotherapie bei Patienten, bei denen Ernährungsumstellung und körperliche Aktivität zur Blutzuckersenkung nicht ausreichen und die für eine Therapie mit Metformin nicht infrage kommen
- als Ergänzungstherapie mit anderen Antidiabetika, wenn diese, zusammen mit Ernährungsumstellung und körperlicher Aktivität, zur Blutzuckersenkung nicht ausreichen.[10]
Frühe Nutzenbewertung
In Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
Im September 2014 wurde bekannt, dass Janssen-Cilag den Vertrieb von INVOKANA in Deutschland einstellt. Grund dafür ist ein schlechtes Abschneiden in einer frühen Nutzenbewertung durch das IQWiG. Dieses stellte INVOKANA keinen Zusatznutzen gegenüber der Standardtherapie mit Glimepirid plus Metformin aus.[11][12] Der G-BA schloss sich dieser Bewertung an.[13] Janssen-Cilag musste aufgrund dieser Bewertung mit Problemen bei der Preisverhandlung mit den Krankenkassen rechnen und beschloss INVOKANA vom Markt zu nehmen. Der G-BA wurde für diese Entscheidung von der Deutschen Diabetes-Gesellschaft scharf kritisiert, da der G-BA mit dieser Entscheidung die Einführung von neuen, effektiveren Arzneimitteln mit besserem Sicherheitsprofil verhindere.[14]
Nachdem der G-BA 2015 auf Basis einer entsprechenden IQWiG-Dossierbewertung auch für die Fixkombination aus Canagliflozin und Metformin mit dem Handelsnamen VOKANAMET keinen Zusatznutzen feststellte,[15][16] kündigte Janssen-Cilag an, auch dieses Arzneimittel vom deutschen Markt zu nehmen.[17]
Neuere Studie
Bei Diabetikern konnte das Fortschreiten der chronischen Nierenkrankheit mittels Canagliflozin in einer CREDENCE-Studie signifikant verlangsamt werden. Nephrologen sprechen von einem Meilenstein. Zusätzlich zur Standardtherapie (RAAS-Blockade mit ACE-Hemmern) kann es das Fortschreiten der chronischen Nierenkrankheit (CKD) signifikant verlangsamen.[18]
Einzelnachweise
- ↑ a b c d Eintrag zu Canagliflozin bei Toronto Research Chemicals, abgerufen am 18. Januar 2022 (PDF).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ T. Nagata, M. Fukazawa, K. Honda, T. Yata, M. Kawai, M. Yamane, N. Murao, K. Yamaguchi, M. Kato, T. Mitsui, Y. Suzuki, S. Ikeda, Y. Kawabe: Selective SGLT2 inhibition by tofogliflozin reduces renal glucose reabsorption under hyperglycemic but not under hypo- or euglycemic conditions in rats. In: Am J Physiol Endocrinol Metab. 304, 2013, S. 414–423, doi:10.1152/ajpendo.00545.2012. PMID 23249697.
- ↑ L. H. Opie: Sodium glucose co-transporter 2 (SGLT2) inhibitors: new among antidiabetic drugs. In: Cardiovasc Drugs Ther. 28, 2014, S. 331–334, doi:10.1007/s10557-014-6522-0. PMID 24825435.
- ↑ E. Dietrich, J. Powell, J. R. Taylor: Canagliflozin: a novel treatment option for type 2 diabetes. In: Drug Des Devel Ther. 7, 2013, S. 1399–1408, doi:10.2147/DDDT.S48937. PMID 24285921.
- ↑ A. K. Niazi, S. H. Niazi: A novel strategy for the treatment of diabetes mellitus - sodium glucose cotransport inhibitors In: N Am J Med Sci. 2, 2010, S. 556–560, doi:10.4297/najms.2010.2556. PMID 22558567.
- ↑ M. Pfister, J. M. Whaley, L. Zhang, J. F. List: Inhibition of SGLT2: a novel strategy for treatment of type 2 diabetes mellitus In: Clin Pharmacol Ther. 89, 2011, S. 621–625, doi:10.1038/clpt.2011.16. PMID 21346749.
- ↑ Bruce Neal, Vlado Perkovic, Kenneth W. Mahaffey, Dick de Zeeuw, Greg Fulcher: Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. In: New England Journal of Medicine. 12. Juni 2017, doi:10.1056/nejmoa1611925.
- ↑ Clinical Trial Results Find Increased Risk of Leg and Foot Amputations
- ↑ Product information Invokana. European Commission’s Directorate for public health and risk assessment.
- ↑ A14-12 Canagliflozin - Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 26. März 2020
- ↑ A14-24 Addendum zum Auftrag A14-12 (Canagliflozin). iqwig.de; abgerufen am 26. März 2020.
- ↑ Nutzenbewertungsverfahren zum Wirkstoff Canagliflozin (Diabetes Mellitus Typ 2). g-ba.de; abgerufen am; abgerufen am
- ↑ Vertriebsstopp: Kein Canagliflozin für deutsche Diabetiker. In: Pharmazeutische Zeitung online, 26. September 2014.
- ↑ A14-27 Canagliflozin/Metformin - Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 26. März 2020
- ↑ Nutzenbewertungsverfahren zum Wirkstoff Canagliflozin/Metformin (Diabetes Mellitus Typ 2). g-ba.de; abgerufen am 26. März 2020.
- ↑ Nach G-BA-Beschluss: Janssen stellt Vokanamet-Vertrieb ein. In: Deutsche Apotheker Zeitung online, 17. Februar 2015.
- ↑ Vlado Perkovic, Meg J. Jardine u. a.: Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. In: New England Journal of Medicine, 14. April 2019, doi:10.1056/NEJMoa1811744.
Auf dieser Seite verwendete Medien
Structure of canagliflozin; Invokana; TA-7284