Ausstrich (Mikrobiologie)
Ausstrich (auch Verdünnungsausstrich) bezeichnet in der Mikrobiologie eine Methode zur Vereinzelung von Mikroorganismen auf der Oberfläche fester Nährmedien (Gelnährmedien).[1][2]
Zweck
Unter Ausstrich versteht man in der Mikrobiologie die Verteilung von Mikroorganismen auf der Oberfläche eines gelartigen Kulturmediums (Nährmediums). Dadurch sollen die Mikroorganismen möglichst einzeln auf der Oberfläche verteilt werden. Dies ermöglicht, dass bei ihrer anschließenden Vermehrung Kolonien mit einer großen Anzahl von Individuen gebildet werden, die sich jeweils im Idealfall aus einem einzelnen Individuum entwickelt haben, also einen Klon (mehrere genetisch identische Individuen) darstellen, eine sogenannte Reinkultur. Das Verfahren wird hauptsächlich für drei Ziele angewendet: (a) Gewinnung von Reinkulturen, die für weitere Untersuchungen zur Verfügung stehen. (b) Ermittlung von Eigenschaften der in gesonderten Kolonien gewachsenen Mikroorganismen. (c) Übersicht über die verschiedenen Mitglieder einer Mikroorganismen-Population, soweit diese sich unter den angewendeten Kulturbedingungen vermehren. Möglich ist dies, weil sich die Kolonien verschiedener Mikroorganismen fast immer anhand ihrer Merkmale unterscheiden lassen.
Prinzip
Ein Ausstrich zur Vereinzelung von Mikroorganismen wird in der Regel auf der glatten Oberfläche eines Nährbodengels vorgenommen, sogenanntes Ausplattieren. Für die Verteilung von Mikroorganismen auf der Oberfläche eines gelartigen Nährbodens durch Ausstreichen ist es erforderlich, dass das verteilende Werkzeug (Impföse, Glasspatel) gut auf dieser Oberfläche gleitet. Das ist dadurch gegeben, dass sich auf der Oberfläche eines Agar-Gels durch Synärese eine sehr dünne Flüssigkeitsschicht bildet, die ein Gleiten von festen Gegenständen auf der Geloberfläche ermöglicht. Durch das Vereinzeln können Reinkulturen erzeugt werden, indem man die vereinzelten Mikroorganismen unter geeigneten Kulturbedingungen sich vermehren und dadurch Kolonien auf der Oberfläche des Nährbodengels bilden lässt. Die Kolonien besitzen je nach Art des jeweiligen Mikroorganismus, Art des Kulturmediums und der sonstigen Kulturbedingungen ein charakteristisches Aussehen: Farbe, Form (beispielsweise glatter oder rauer Rand), Oberfläche (beispielsweise glänzend oder matt). Diese Merkmale können – neben anderen – zur Unterscheidung verschiedener Mikroorganismen und zu ihrer Identifizierung, also der Zuordnung zu einer Art, verwendet werden. Das Nährbodengel befindet sich bei diesen Verfahren in der Regel in runden, flachen Kunststoff- oder Glasschalen mit übergreifendem Deckel, sogenannten Petrischalen. Das Nährbodengel bedeckt darin den Boden und bildet eine sogenannte Nährbodenplatte, oft kurz als Platte bezeichnet. Ausstrichwerkzeuge, Petrischalen und Nährboden müssen steril sein. Zur Vereinzelung der Mikroorganismen auf der Geloberfläche gibt es verschiedene Verfahren.
Ausstrich mit einer Impföse
Eine geringe Menge der Mikroorganismen oder des Mikroorganismen-haltigen Materials wird mit einer sterilen Impföse aufgenommen und durch serpentinenartige Seitwärtsbewegungen der Impföse auf der glatten Oberfläche des Nährmediumgels verteilt. Durch das fortgesetzte Abstreifen der Mikroorganismenmasse von der Impföse kommt es zu einem Verdünnungseffekt und die Anzahl an abgegebenen Mikroorganismen pro Fläche sinkt, bis Individuen so weit voneinander zu liegen kommen, dass sich daraus bei Inkubation unter geeigneten Bedingungen vereinzelte, voneinander getrennte Kolonien entwickeln, die sich im Idealfall jeweils aus einem einzigen Individuum durch dessen Vermehrung entwickelt haben, also Klone darstellen. Statt einer Impföse werden gelegentlich auch sterile Wattestäbchen verwendet. Der Vorteil des Impfösenausstrichs ist, dass man für jede Vereinzelung jeweils nur eine Agargelplatte benötigt und dass man mit nur einer Impföse arbeiten kann, die man zwischen den Arbeitsgängen jeweils durch Ausglühen in einer Flamme sterilisieren kann. Der Nachteil ist, dass die Mikroorganismen-Individuen oft nicht getrennt, also vereinzelt werden können, wenn sie fest aneinander haften, beispielsweise durch sehr konsistente Schleimhüllen. Weiterhin werden im Vergleich zum Verfahren mit einem Drigalskispatel weniger isolierte Kolonien erhalten und damit ein nicht so umfassender Überblick über die im Material enthaltenen verschiedenen Mikroorganismen.
Ausstrich mit einem Drigalskispatel
Eine geringe Menge der Mikroorganismen oder des Mikroorganismen-haltigen Materials wird auf die Oberfläche einer Agarplatte gebracht und dort mit einem entsprechend geformten Glasstab (siehe Bild), einem sogenannten Drigalskispatel, möglichst gleichmäßig verteilt. Mit demselben Spatel und seiner selben Seite wird eine zweite, sterile Agarplatte bestrichen, ohne dass vorher auf diese zweite Platte Mikroorganismenmaterial aufgetragen wurde. Hierbei werden noch am Spatel anhaftende Mikroorganismen auf der Agarplatte verteilt. Das wird nun noch auf einer dritten sterilen Agarplatte wiederholt. Bei diesem Verfahren („Ausstreichen in fallender Reihe“) wird jeweils nur ein sehr kleiner Teil des Mikrooganismenmaterials auf die nächste Agarplatte übertragen, so dass es meistens schon auf der zweiten, jedenfalls aber auf der dritten Agarplatte zu einer Vereinzelung der Mikroorganismen kommt, so dass sich isoliert stehende Kolonien entwickeln. Der Vorteil des Drigalskiausstrichs ist, dass die Mikroorganismen-Individuen durch das Quetschen zwischen Glasspatel und Geloberfläche besser voneinander getrennt werden als beim Impfösenausstrich und dass eine im Vergleich zum Impfösenausstrich größere Anzahl isolierter Kolonien erhalten wird und damit ein umfassenderer Überblick über die im Material enthaltenen verschiedenen Mikroorganismen und ihr ungefähres Mengenverhältnis. Der Nachteil ist, dass je Ausstrich drei Agarplatten benötigt werden statt nur einer, und dass die Drigalskispatel vorher durch Erhitzen in einem Heizschrank oder einem Sterilisationsautoklaven in größerer Anzahl sterilisiert werden müssen.
Verteilung mit Glasperlen
Beim Glasperlen-Verfahren verwendet man zur Verteilung und Vereinzelung der Mikroorganismen sterile Glasperlen.
Anwendungen
Meistens wird ein Ausstrich zur Isolierung einer klonalen Kolonie verwendet. Die Kolonien besitzen daneben, je nach Art des jeweiligen Mikroorganismus, Art des Kulturmediums und der Kulturbedingungen ein charakteristisches Aussehen: Farbe, Form (glatter oder rauer Rand), Oberfläche (glänzend oder matt). Diese Merkmale können zur Identifizierung des Mikroorganismus, also der Zuordnung zu einer Art verwendet werden. Ausstriche mit Drigalskispatel oder Glasperlen werden unter anderem zur Bestimmung der Lebendzellzahl durch eine Plattenauszählung verwendet, da sie im Gegensatz zur Verwendung einer Impföse zu einer gleichmäßigen Verteilung der Mikroorganismen führen.
Durch ein besonderes Verfahren, der so genannten Stempeltechnik können die durch Ausstrich und Inkubation erhaltenen Mikroorganismen-Kolonien unter Erhalt der Positionen der Kolonien zueinander auf die Oberfläche anderer gelbasierter Kulturmedien übertragen werden. Hierzu sind einzeln stehende Kolonien erforderlich, wie sie nach einem Ausstrich mit einem Drigalskispatel entstehen.
Abgrenzung des Begriffs
In der Hämatologie werden Ausstriche zur direkten mikroskopischen Beurteilung von Zellen verwendet, teilweise in Verbindung mit einer vorangehenden histologischen oder immunologischen Färbung,[3][4] z. B. ein Blutausstrich.
Geschichte
Der Ausstrich von Mikroorganismen auf Nährmedien in Petrischalen wurde erstmals von Friedrich Loeffler und Georg Gaffky im Labor von Robert Koch durchgeführt.
Siehe auch
Weblinks
- Eintrag zu Verdünnungsausstrich im Flexikon, einem Wiki der Firma DocCheck
- Grundtechniken der Mikrobiologie - Festmedium Vereinzelungsausstrich (Video). In: Institut für Mikrobiologie und Genetik, Georg-August-Universität Göttingen. 2. April 2015, abgerufen am 17. März 2018.
Einzelnachweise
- ↑ Georg Fuchs, Thomas Eitinger, Hans Günter Schlegel: Allgemeine Mikrobiologie. Georg Thieme Verlag, 2007. ISBN 9783134446081. S. 168.
- ↑ Katharina Munk: Mikrobiologie. Georg Thieme Verlag, 2008. ISBN 9783131520111. S. 297.
- ↑ Barbara J. Bain, Dieter Huhn: Roche Grundkurs hämatologische Morphologie. Band 7 von Ex libris Roche, Georg Thieme Verlag, 1997. ISBN 9783894122997. S. 43–45.
- ↑ Axel M. Gressner, Torsten Arndt: Lexikon der Medizinischen Laboratoriumsdiagnostik. 2. Ausgabe, Springer-Verlag, 2013. ISBN 9783642129216. S. 480.
Auf dieser Seite verwendete Medien
Autor/Urheber: Dieses Diagramm wurde mit Microsoft Word erstellt., Lizenz: CC-BY-SA-3.0
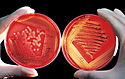
Agar plate being streaked with bacteria.
Sheep blood is added to growth media to enhance the nutrients available for bacterial growth. Laboratory scientists grow various bacteria on this medium as well as numerous other media, in order to help assess infections in humans and animals. The image on the right shows growth of a beta-hemolytic streptococcus. The bacterium has produced a hemolytic compound that has lysed the red blood cells surrounding each colony. The plate was properly streaked to attain isolated colonies. The plate on the left is growing a Staphylococcus species. The plate was streaked too heavily, so isolated colonies were not attained.