Aporphin-Alkaloide

Aporphin-Alkaloide sind in der Natur vorkommende chemische Verbindungen aus der Gruppe der Alkaloide. Sie stellen nach den Benzylisochinolinalkaloiden die zweitgrößte Gruppe der Isochinolin-Alkaloide dar.
Bisher wurden 85 Aporphin-Alkaloide aus Pflanzen von 15 Familien isoliert; der bekannteste Vertreter ist das Apomorphin. Die Aporphin-Alkaloide interessieren vor allem wegen ihrer Nähe zum Morphin.
Vorkommen


Die Aporphin-Alkaloide sind am häufigsten in Pflanzen nachzuweisen.
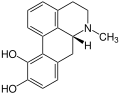
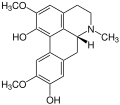
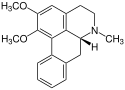
Beispielsweise kommt Isoboldin in den Pflanzen Beilschmiedia, Nandina (Nandina domestica, oder Himmelsbambus), Hornmohn (Glaucium) und weiteren Pflanzen vor. Wie der Name es schon vermuten lässt, wurde das Glaucin als erstes im Hornmohn (Glaucium) nachgewiesen und üblicherweise leitet sich der Name der Alkaloide von den Pflanzen ab, in denen sie als erstes nachgewiesen worden sind.
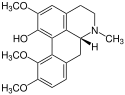
Corydin als weiterer Vertreter der Aporphin-Alkaloide ist in den Lerchensporne (Corydalis), Herzblumen (Dicentra) und ebenfalls im Hornmohn (Glaucium) enthalten.
Vertreter
Apoglaziovin
Apomorphin
Bulbocapnin
Corydin
Glaucin
Isoboldin
Isothebain
Nuciferin
Die Aporphin-Alkaloide unterscheiden sich durch ihre unterschiedlichen Substituenten und durch deren Stellung an der Grundstruktur. Des Weiteren ist ihre Stereochemie teilweise verschieden, am häufigsten sind sie (R)-konfiguriert, jedoch sind z. B. Glaucin, Bulbocapnin und Isothebain (S)-konfiguriert.[1]
Biosynthese
Reticulin 1 wird im ersten Schritt oxidiert, wobei ein mesomeriestabilisiertes Diradikal mit den Grenzstrukturen 2a und 2b entsteht. Durch Cyclisierung entsteht ein vierter Sechsring: Corytuberin 3, welches dann zu Bulbocapnin 4 dehydriert.[2] Schematische Darstellung:

Im Labor lassen sich Aporphin-Alkaloide wie Isoboldin oder Isothebain beispielsweise auch aus Reticulin durch oxidative Phenolkupplung durch Kaliumhexacyanoferrat oder Eisen(III)-chlorid synthetisieren. Es lassen sich auch leicht Proaporphine in Aporphin-Alkaloide umwandeln.
Chemie

Die Aporphin-Alkaloide interessieren vor allem wegen der Nähe zum Morphin und der Benzylisochinolinalkaloide. So lässt sich beispielsweise, wie es der Name schon erschließen lässt, aus Morphin Apomorphin herstellen. Dies kann mittels Zugabe einer Säure unter Hitzeeinwirkung ablaufen.
Die Proaporphin-Alkaloide und die Aporphin-Alkaloide teilen eine Gerüstisomerie.
Die Aporphin-Alkaloide besitzen in der Regel ein Stereozentrum.
Das (R)-konfigurierte Glaucin lässt sich synthetisch aus (S)-Glaucin herstellen.
Verwendung
Aporphin-Alkaloide haben überwiegend eine pharmakologische Bedeutung, da viele von ihnen auf Organismen wirken. Dabei ist das pharmakologische Wirkungsspektrum sehr breit und die Wirkungsweisen auf die verschiedenen Spezies sehr unterschiedlich:
Bei Kaninchen wurde eine Erhöhung des Darmmuskeltonus durch Isothebain nachgewiesen. Bei Ratten bewirkte es eine Stimulation der Uterus-Muskulatur und eine entzündungshemmende Wirkung. Bei Mäusen kann es dagegen zu motorischen Störungen und zu einem verringerten Schmerzempfinden kommen.
Glaucin soll den Blutdruck reduzieren und wirkt bei Katzen atemhemmend. Zudem soll es den Hustenreiz ähnlich wie Codein unterdrücken, nur soll es eine längere Wirkungsdauer als Codein besitzen. Das Derivat des Glaucins Dehydroglaucin wirkt antibakteriell.
Corydin wirkt als Beruhigungsmittel, senkt den Blutdruck und blockiert Nervenimpulse.
Bulbocapnin soll die Wirkungen von Apomorphin und Amphetamin blockieren. Es wirkt auf das zentrale Nervensystem und kann bei Mäusen eine Katalepsie auslösen. Es soll jedoch auch beruhigend und schmerzstillend wirken.
Apomorphin wirkt blutdrucksenkend und ist auch ein starkes Brechmittel. Hauptsächlich wird es wegen seiner stimulierenden Wirkung auf Dopamin-Rezeptoren als Mittel gegen die Parkinson-Krankheit eingesetzt.[3]
In der afrikanischen Volksmedizin gilt die Pflanze Cassytha (Cassytha filiformis) als Medikament gegen Krebs. Eine Studie zeigte, dass die Pflanze viele Aporphin-Alkaloide enthält und die drei Haupt-Alkaloide Actinodaphnin, Cassythin und Dicentrin in vitro Auswirkungen auf Krebszellen haben.[4]
Literatur
- P. Nuhn, L. Wessjohann: Naturstoffchemie: Mikrobielle, pflanzliche und tierische Naturstoffe. S. Hirzel Verlag, Stuttgart 2006, ISBN 3-7776-1363-0.
- M. Hesse, H. O. Bernhard: Alkaloide: außer Indol-, Triterpen- und Steroidalkaloide. Verlag Chemie, Weinheim 1975, ISBN 3-527-25620-2.
- Geoffrey A. Cordell: Introduction to Alkaloids: A Biogenetic Approach. John Wiley & Sons, Kanada 1981, ISBN 0-471-03478-9.
Einzelnachweise
- ↑ K. W. Bentley, H. M. E. Cardwell: The Morphine-Thebaine group of alkaloids. Part V. The absolute stereochemistry of the morphine, benzylisoquinoline, aporphine, and tetrahydroberberine alkaloids. In: Journal of the Chemical Society. Oxford 1955, S. 3252–3260, doi:10.1039/JR9550003252.
- ↑ G. Blaschke: Mechanismusder Diphenylverknüpfung bei der Biosynthese von Aporphin-Alkaloiden. 3. Mitt.: Untersuchung zur Biosynthese von Alkaloiden. In: Archiv der Pharmazie. 303 (4), 1970, S. 358–363, doi:10.1002/ardp.19703030411.
- ↑ Geoffrey A. Cordell: Introduction to Alkaloids: A Biogenetic Approach. John Wiley & Sons, Kanada 1981, ISBN 0-471-03478-9, S. 406–408.
- ↑ S. Hoet, C. Stevigny, S. Block, F. Opperdoes, P. Colson, B. Baldeyrou, A. Lansiaux, C. Bailly, J. Quetin-Leclercq: Alkaloids from Cassytha filiformis and related aporphines: antitrypanosomal activity, cytotoxicity, and interaction with DNA and topoisomerases. In: Planta Med. 70 (5), Thieme Verlag, Stuttgart 2004, S. 407–413, doi:10.1055/s-2004-818967.
Auf dieser Seite verwendete Medien
(c) Forest & Kim Starr, CC BY 3.0
Cassytha filiformis (flowers). Location: Kure Atoll, Inland