Aggregatzustand
Ein Aggregatzustand ist die Art der Verbindung und Verschiebbarkeit der kleinsten Teile, aus denen Materie zusammengesetzt ist. Anders formuliert sind Aggregatzustände fundamentale Erscheinungsformen von Materie, die sich jeweils sprunghaft in der Mobilität ihrer Atome und Moleküle sowie in der Stärke der Wechselwirkungen zwischen diesen unterscheiden.[1][2][3] Die klassischen Aggregatzustände fest, flüssig und gasförmig lassen sich daher sensorisch anhand ihrer unterschiedlichen makroskopischen mechanischen und rheologischen Eigenschaften identifizieren.[4] Daneben werden in der Physik auch weitere, in der Biosphäre der Erde nicht oder kaum natürlich vorkommende Erscheinungsformen der Materie als Aggregatzustand bezeichnet. So gilt Plasma, aus dem beispielsweise die Sonne besteht, als vierter Aggregatzustand der Materie.[5]
Bestimmte Stoffe, wie etwa Flüssigkristalle, viskoelastische Stoffe oder Schmelzen besonders langkettiger Polymere, können Merkmale sowohl des festen als auch des flüssigen Aggregatzustandes aufweisen. Gläser ataktischer Polymere mit hohen Molekulargewichten werden oft als Festkörper betrachtet, obwohl es sich bei diesen lediglich um Flüssigkeiten mit einer – verglichen mit den Zeitskalen menschlicher Wahrnehmung – stark verlangsamten Dynamik handelt.[6][7]
Der Begriff Aggregatzustand ist vom enger gefassten Begriff Phase abzugrenzen. Eine Phase ist innerhalb eines Materials ein räumlich begrenzter Bereich, der chemisch und physikalisch einheitliche Eigenschaften aufweist.[8] Ein Aggregatzustand kann mehrere Phasen umfassen. Beispielsweise können homogene Feststoffe bei unterschiedlichen Temperaturen und Drücken in unterschiedlichen Kristallmodifikationen vorliegen, die durch enantiotrope Umwandlungen ineinander überführbar sind und die jeweils eine eigene Phase darstellen. Heterogene Gemische können einheitlich im festen oder flüssigen Aggregatzustand vorliegen, aber mehrere Phasen unterschiedlicher stofflicher Zusammensetzungen enthalten. Bei Gasen und Plasmen lassen sich die Begriffe Aggregatzustand und Phase synonym verwenden.
Die Überführung eines Stoffes in einen anderen Aggregatzustand erfolgt durch einen Phasenübergang, der sich durch eine Zustandsänderung herbeiführen lässt, etwa durch eine Änderung der Temperatur, des Drucks oder des Volumens. Die Grenzen zwischen den verschiedenen Aggregatzuständen im Zustandsraum eines Stoffes lassen sich graphisch mit Hilfe von Phasendiagrammen darstellen.
Die drei klassischen Aggregatzustände

Übersicht
Es gibt drei klassische Aggregatzustände:
- fest (f alternativ s[9]): In diesem Zustand behält ein Stoff meist sowohl Form als auch Volumen bei.
- flüssig (fl alternativ l[10]): Hier wird das Volumen beibehalten, aber die Form ist unbeständig und passt sich dem umgebenden Raum an.
- gasförmig (g): Hier entfällt auch die Volumenbeständigkeit, ein Gas füllt den zur Verfügung stehenden Raum vollständig aus.
Für feste Stoffe und flüssige Stoffe gibt es den zusammenfassenden Begriff kondensierte Materie. Flüssigkeiten und Gase werden in der Physik unter dem Oberbegriff Fluide zusammengefasst.
Bei Feststoffen unterscheidet man auch nach anderen Merkmalen:
- kristallin: Ein Feststoff, der seine Form nicht verändert. Seine Bausteine, die Kristalle, weisen eine Fernordnung auf.
- amorph: Ein Feststoff, der lediglich durch eine Nahordnung ausgezeichnet ist, siehe amorphes Material. Ein amorpher Festkörper ist metastabil.
Die klassischen Aggregatzustände lassen sich mit einem Teilchenmodell erklären, das die kleinsten Teilchen eines Stoffes (Atome, Moleküle, Ionen) auf kleine Kugeln reduziert. Die mittlere kinetische Energie aller Teilchen ist in allen Zuständen ein Maß für die Temperatur. Die Art der Bewegung ist in den drei Aggregatzuständen jedoch völlig unterschiedlich. Im Gas bewegen sich die Teilchen geradlinig wie Billardkugeln, bis sie mit einem anderen oder mit der Gefäßwand zusammenstoßen. In der Flüssigkeit müssen sich die Teilchen durch Lücken zwischen ihren Nachbarn hindurchzwängen (Diffusion, Brownsche Molekularbewegung). Im Festkörper schwingen die Teilchen nur um ihre Ruhelage.
Fest
Bewegung
Die kleinsten Teilchen sind bei einem Feststoff nur wenig in Bewegung. Sie schwingen um eine feste Position, ihren Gitterplatz, und rotieren meist um ihre Achsen. Je höher die Temperatur wird, desto heftiger schwingen bzw. rotieren sie, und der Abstand zwischen den Teilchen nimmt (meist) zu. Ausnahme: Dichteanomalie.
- Die Form des Feststoffes bleibt unverändert.
- Stoffe im festen Aggregatzustand lassen sich nur schwer aufteilen.
- Sie lassen sich nur schwer verformen (geringe Verformbarkeit, spröde).
Hinweis: Betrachtet man die Teilchen mit quantenmechanischen Grundsätzen, so dürfen aufgrund der Heisenbergschen Unschärferelation eigentlich Teilchen nie ruhig stehen. Sie haben kleine Schwingungen, die man auch als Nullpunktsfluktuationen bezeichnet. Das entspricht dem Grundzustand des harmonischen Oszillators.
Anziehung
Zwischen den kleinsten Teilchen wirken verschiedene Kräfte, nämlich die Van-der-Waals-Kräfte, die elektrostatische Kraft zwischen Ionen, Wasserstoffbrückenbindungen oder kovalente Bindungen. Die Art der Kraft ist durch den atomaren Aufbau der Teilchen (Ionen, Moleküle, Dipole …) bestimmt. Bei Stoffen, die auch bei hohen Temperaturen fest sind, ist die Anziehung besonders stark.
Anordnung
Durch die schwache Bewegung und den festen Zusammenhalt sind die Teilchen regelmäßig angeordnet.
- Die meisten festen Reinstoffe haben deshalb eine regelmäßige Struktur (Kristall), nur wenige sind amorph.
- Die Teilchenanordnung in einem amorphen Festkörper ist ähnlich ungeordnet wie in der Flüssigkeit, er ist jedoch formstabil, da die Teilchenbewegungen gegeneinander weitgehend eingefroren sind.
Abstand
Durch die starke Anziehung sind die Teilchen eng beieinander (hohe Packungsdichte)
- Das Volumen eines Feststoffes lässt sich durch Kompression nach den Gesetzen der Elastizitätstheorie, abhängig von der Größe des Kompressionsmoduls bzw. des E-Moduls, verringern.
- Temperaturänderungen bewirken ebenso eine Veränderung des Volumens nach den Gesetzen der Wärmeausdehnung.
Flüssig
Bewegung
Die Teilchen sind nicht wie beim Feststoff ortsfest, sondern können sich gegenseitig verschieben. Bei Erhöhung der Temperatur werden die Teilchenbewegungen immer schneller.
Anziehung
Durch die Erwärmung ist die Bewegung der Teilchen so stark, dass die Wechselwirkungskräfte nicht mehr ausreichend sind, um die Teilchen an ihrem Platz zu halten. Die Teilchen können sich nun frei bewegen.
- Ein flüssiger Stoff verteilt sich von allein, wenn er nicht in einem Gefäß festgehalten wird.
- Ein Farbstoff verteilt sich von allein in einer Flüssigkeit (Diffusion).
Abstand
Obwohl der Abstand der Teilchen durch die schnellere Bewegung ein wenig größer wird (die meisten festen Stoffe nehmen beim Schmelzen einen größeren Raum ein), hängen die Teilchen weiter aneinander. Für die Verringerung des Volumens einer Flüssigkeit durch Kompression gilt ähnliches wie bei einem Festkörper, wobei der entsprechende Kompressionsmodul der Flüssigkeit zum Tragen kommt. Bei einer Temperaturverringerung wird das Volumen ebenfalls kleiner, bei Wasser jedoch nur bis zu einer Temperatur von 4 °C (Anomalie des Wassers), während darunter bis 0 °C das Volumen wieder ansteigt.
Anordnung
Obwohl die Teilchen sich ständig neu anordnen und Zitter-/Rotationsbewegungen durchführen, kann eine Anordnung festgestellt werden. Diese Nahordnung ist ähnlich wie im amorphen Festkörper, die Viskosität ist jedoch sehr viel niedriger, d. h., die Teilchen sind beweglicher.
Gasförmig
Bewegung
Bei Stoffen im gasförmigen Zustand sind die Teilchen schnell in Bewegung. Ein Gas oder gasförmiger Stoff verteilt sich schnell in einem Raum. In einem geschlossenen Raum führt das Stoßen der kleinsten Teilchen gegen die Wände zum Druck des Gases.
Anziehung
Beim gasförmigen Zustand ist die Bewegungsenergie der kleinsten Teilchen so hoch, dass sie nicht mehr zusammenhalten. Die kleinsten Teilchen des gasförmigen Stoffes verteilen sich gleichmäßig im gesamten zur Verfügung stehenden Raum.
Abstand
Durch die schnelle Bewegung der Teilchen in einem Gas sind sie weit voneinander entfernt. Sie stoßen nur hin und wieder einander an, bleiben aber im Vergleich zur flüssigen Phase auf großer Distanz. Ein gasförmiger Stoff lässt sich komprimieren, d. h., das Volumen lässt sich verringern.
Anordnung
Wegen der Bewegung sind die Teilchen ungeordnet.
In der physikalischen Chemie unterscheidet man zwischen Dampf und Gas. Beide sind physikalisch gesehen nichts anderes als der gasförmige Aggregatzustand; die Begriffe haben auch nicht direkt mit realem Gas und idealem Gas zu tun. Was umgangssprachlich als „Dampf“ bezeichnet wird, ist physikalisch gesehen eine Mischung aus flüssigen und gasförmigen Bestandteilen, welche man im Falle des Wassers als Nassdampf bezeichnet.
Bei einem Dampf im engeren Sinn handelt es sich um einen Gleichgewichtszustand zwischen flüssiger und gasförmiger Phase. Er kann, ohne Arbeit verrichten zu müssen, verflüssigt werden, das heißt beim Verflüssigen erfolgt kein Druckanstieg. Ein solcher Dampf wird in der Technik als Nassdampf bezeichnet im Gegensatz zum sogenannten Heißdampf oder überhitzten Dampf, der im eigentlichen Sinn ein reales Gas aus Wassermolekülen darstellt und dessen Temperatur oberhalb der Kondensationstemperatur der flüssigen Phase beim jeweiligen Druck liegt.
Ausgewählte Reinstoffe als Beispiele
Reinstoffe werden entsprechend ihrem Aggregatzustand bei einer Temperatur von 20 °C (siehe Raumtemperatur) und einem Druck von 1013,25 hPa (Normaldruck) als Feststoff, Flüssigkeit oder Gas bezeichnet. Beispiel: Brom ist bei Raumtemperatur und Normaldruck flüssig (siehe Tabelle), also gilt Brom als Flüssigkeit.
Diese Bezeichnungen (Feststoff, Flüssigkeit, Gas) werden zwar auch gebraucht, wenn Stoffe unter veränderten Bedingungen einen anderen Aggregatzustand annehmen. Im engeren Sinne bezieht sich die Einteilung jedoch auf die oben genannten Standardbedingungen; jeder Stoff gehört dann zu einer der Kategorien.
| Stoff | Schmelztemperatur1 | Siedetemperatur1 | Aggregatzustand im Gefrierschrank (−10 °C)1 | Aggregatzustand bei Raumtemperatur (25 °C)1 | Aggregatzustand im Backofen (150 °C)1 |
|---|---|---|---|---|---|
| Eisen | 1535 °C | 2750 °C | fest | fest | fest |
| Kupfer | 1084 °C | 2567 °C | fest | fest | fest |
| Caesium | 28 °C | 671 °C | fest | fest | flüssig |
| Sauerstoff | −219 °C | −183 °C | gasförmig | gasförmig | gasförmig |
| Helium | −272 °C | −269 °C | gasförmig | gasförmig | gasförmig |
| Brom | −7 °C | 59 °C | fest | flüssig | gasförmig |
| Chlor | −101 °C | −35 °C | gasförmig | gasförmig | gasförmig |
| Wasser | 0 °C | 100 °C | fest | flüssig | gasförmig |
1 bei Normaldruck
Aggregatzustände in Gemischen
Bei der Vermischung von Stoffen ergeben sich abhängig vom Aggregatzustand der Bestandteile und ihrem mengenmäßigen Anteil charakteristische Gemische, zum Beispiel Nebel oder Schaum.
Änderung des Aggregatzustands
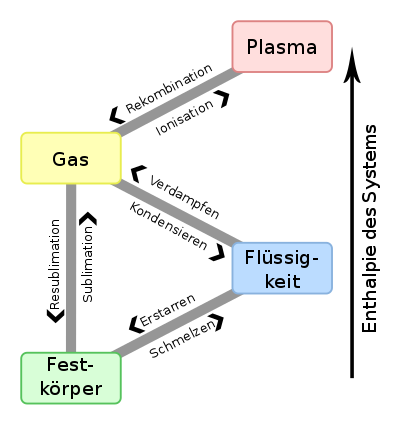
Die Übergänge zwischen den verschiedenen Aggregatzuständen haben spezielle Namen (eoc, omc, eon) und spezielle Übergangsbedingungen, die bei Reinstoffen aus Druck und Temperatur bestehen. Diese Übergangsbedingungen entsprechen dabei Punkten auf den Phasengrenzlinien von Phasendiagrammen. Hierbei ist für jeden Phasenübergang eine bestimmte Wärmemenge notwendig bzw. wird dabei freigesetzt.
| von↓ nach→ | Feststoff | Flüssigkeit | Gas |
|---|---|---|---|
| Feststoff | – | Schmelzen am Schmelzpunkt (Schmelzenthalpie) | Sublimation/Sublimieren am Sublimationspunkt (Sublimationsenthalpie) |
| Flüssigkeit | Erstarren/Gefrieren am Gefrierpunkt (Erstarrungsenthalpie) | – | Verdampfung/Sieden am Siedepunkt (Verdampfungsenthalpie) |
| Gas | Resublimation/Resublimierung am Resublimationspunkt (Resublimationsenthalpie) | Kondensation am Kondensationspunkt (Kondensationsenthalpie) | – |
Die Sublimation und das Verdampfen kommen auch unterhalb der Sublimations- beziehungsweise Siedepunktes vor. Man spricht hier von einer Verdunstung.
Alltagsbeispiele

Alle Übergänge können am Beispiel Wasser im Alltag beobachtet werden (siehe Abbildung):
Schmelzen
Schnee oder Eis fängt im Frühjahr an flüssig zu werden, sobald Temperaturen oberhalb der Schmelztemperatur herrschen.
Erstarren
Kühlt das Wasser in Seen unter den Gefrierpunkt ab, bilden sich Eiskristalle, die mit der Zeit immer größer werden, bis die Oberfläche mit einer Eisschicht überzogen ist.
Verdampfen
Wird Wasser im Kochtopf über seine Siedetemperatur erhitzt, so wird das Wasser gasförmig. Das „Blubbern“ im Kochtopf kommt zustande, weil das Wasser am heißen Topfboden zuerst die Siedetemperatur erreicht. Die aufsteigenden Blasen sind der Wasserdampf, der (wie die meisten gasförmigen Stoffe) unsichtbar ist. Verdunstung, der Übergang von flüssig in gasförmig ohne Erreichen der Siedetemperatur, ist bei Schweiß auf der Haut gut zu beobachten.
Kondensieren
Der deutlich sichtbare Nebel oberhalb kochenden Wassers, der meist umgangssprachlich als „Dampf“ bezeichnet wird, ist zu winzigen Wassertröpfchen kondensierter Wasserdampf. Tau und Wolken entstehen ebenfalls durch kondensierenden Wasserdampf.
Sublimation
Gefrorene Pfützen können im Winter, auch bei Temperaturen weit unterhalb des Gefrierpunktes, durch Sublimation nach und nach „austrocknen“, bis das Eis vollständig sublimiert und die Pfütze verschwunden ist.
Resublimation
Raureif oder Eisblumen, die sich im Winter bilden, entstehen durch den aus der Umgebungsluft resublimierenden Wasserdampf.
Teilchenmodell der Phasenübergänge
Schmelzen
Durch Erhöhen der Temperatur (Zufuhr von thermischer Energie) bewegen sich die kleinsten Teilchen immer heftiger, und ihr Abstand voneinander wird (normalerweise) immer größer. Die Van-der-Waals-Kräfte halten sie aber noch in ihrer Position, ihrem Gitterplatz. Erst ab der sogenannten Schmelztemperatur wird die Schwingungsamplitude der Teilchen so groß, dass die Gitterstruktur teilweise zusammenbricht. Es entstehen Gruppen von Teilchen, die sich frei bewegen können. In ihnen herrscht eine Nahordnung, im Gegensatz zur Fernordnung von Teilchen innerhalb des Kristallgitters fester Stoffe.
Erstarren
Mit Sinken der Temperatur nimmt die Bewegung der Teilchen ab, und ihr Abstand zueinander wird immer geringer. Auch die Rotationsenergie nimmt ab. Bei der sogenannten Erstarrungstemperatur wird der Abstand so klein, dass sich die Teilchen gegenseitig blockieren und miteinander verstärkt anziehend wechselwirken – sie nehmen eine feste Position in einem dreidimensionalen Gitter ein.
Es gibt Flüssigkeiten, die sich bei sinkender Temperatur ausdehnen, beispielsweise Wasser. Dieses Verhalten wird als Dichteanomalie bezeichnet.
Verdampfen und Sublimation
Die Geschwindigkeit der kleinsten Teilchen ist nicht gleich. Ein Teil ist schneller, ein Teil ist langsamer als der Durchschnitt. Dabei ändern die Teilchen durch Kollisionen ständig ihre aktuelle Geschwindigkeit.
An der Grenze eines Festkörpers oder einer Flüssigkeit, dem Übergang einer Phase in eine gasförmige, kann es mitunter vorkommen, dass ein Teilchen von seinen Nachbarn zufällig einen so starken Impuls bekommt, dass es aus dem Einflussbereich der Kohäsionskraft entweicht. Dieses Teilchen tritt dann in den gasförmigen Zustand über und nimmt etwas Wärmeenergie in Form der Bewegungsenergie mit, das heißt die feste oder flüssige Phase kühlt ein wenig ab.
Wird thermische Energie einem System zugeführt und erreicht die Temperatur die Sublimations- oder Siedetemperatur, geschieht dieser Vorgang kontinuierlich, bis alle kleinsten Teilchen in die gasförmige Phase übergetreten sind. In diesem Fall bleibt die Temperatur in der verdampfenden Phase in der Regel unverändert, bis alle Teilchen mit einer höheren Temperatur aus dem System verschwunden sind. Die Wärmezufuhr wird somit in eine Erhöhung der Entropie umgesetzt.
Wenn die Kohäsionskräfte sehr stark sind, beziehungsweise es sich eigentlich um eine viel stärkere Metall- oder Ionenbindung handelt, dann kommt es nicht zur Verdampfung.
Die durch Verdampfen starke Volumenzunahme eines Stoffes kann, wenn sehr viel Hitze schlagartig zugeführt wird, zu einer Physikalischen Explosion führen.
Kondensation und Resublimation
Der umgekehrte Vorgang ist die Kondensation beziehungsweise Resublimation. Ein kleinstes Teilchen trifft zufällig auf einen festen oder flüssigen Stoff, überträgt seinen Impuls und wird von den Kohäsionskräften festgehalten. Dadurch erwärmt sich der Körper um die Energie, die das kleinste Teilchen mehr trug als der Durchschnitt der kleinsten Teilchen in der festen beziehungsweise flüssigen Phase.
Stammt das Teilchen allerdings von einem Stoff, der bei dieser Temperatur gasförmig ist, sind die Kohäsionskräfte zu schwach, es festzuhalten. Selbst wenn es zufällig so viel Energie verloren hat, dass es gebunden wird, schleudert es die nächste Kollision mit benachbarten kleinsten Teilchen wieder in die Gasphase. Durch Absenken der Temperatur kann man den kleinsten Teilchen ihre Energie entziehen. Dadurch ballen sie sich beim Unterschreiten der Sublimations- oder Erstarrungstemperatur durch die Wechselwirkungskräfte mit anderen Teilchen zusammen und bilden wieder einen Feststoff oder eine Flüssigkeit.
Phasendiagramme

Das p-T-Phasendiagramm eines Stoffes beschreibt in Abhängigkeit von Druck und Temperatur, in wie vielen Phasen ein Stoff vorliegt und in welchem Aggregatzustand sich diese befinden. Anhand der Linien kann man also erkennen, bei welchem Druck und welcher Temperatur die Stoffe ihren Aggregatzustand verändern. Gewissermaßen findet auf den Linien der Phasenübergang zwischen den Aggregatzuständen statt, weshalb man diese auch als Phasengrenzlinien bezeichnet. Auf ihnen selbst liegen die jeweiligen Aggregatzustände in Form eines dynamischen Gleichgewichts nebeneinander in verschiedenen Phasen vor.
- Bei einem bestimmten Druck und einer bestimmten Temperatur, dem so genannten Tripelpunkt, können alle drei Aggregatzustände gleichzeitig vorliegen. Es handelt sich dabei um den Punkt in der „Mitte“ des Phasendiagramms, an welchem sich alle drei Phasengrenzlinien treffen. Der Tripelpunkt eignet sich daher als ein Ausgangspunkt dieser Linien und für die Festlegung vieler Temperaturskalen.
- Oberhalb eines bestimmten Druckes und einer bestimmten Temperatur, dem sogenannten kritischen Punkt, können Gas und Flüssigkeit aufgrund ihrer identischen Dichte nicht mehr unterschieden werden. In diesem Zustandsraum kann daher keine Phasengrenzlinie festgelegt werden.
- Für Drücke unterhalb des Tripelpunkt-Druckes kann die Substanz bei einer Senkung der Temperatur nur fest oder bei einer Steigerung der Temperatur nur gasförmig werden. Die Trennlinie zwischen beiden Bereichen nennt man Sublimationskurve. Auf ihr können feste und gasförmige Phasen gleichzeitig existieren. Die Sublimationskurve beginnt theoretisch am absoluten Nullpunkt und endet am Tripelpunkt.
- Für Drücke oberhalb des Tripelpunkt-Druckes ist die Substanz für Temperaturen unterhalb des Schmelzpunktes fest, zwischen Schmelz- und Siedepunkt flüssig und oberhalb des Siedepunktes gasförmig. Die Trennlinie zwischen fester und flüssiger Phase, also die Kurve der Schmelzpunkte, nennt man Schmelzkurve, die Trennlinie zwischen Flüssigkeit und Gas nennt man Siedepunktskurve. Beide Kurven beginnen ebenfalls am Tripelpunkt, wobei sich die Schmelzkurve theoretisch bis in das Unendliche fortsetzt und die Siedepunktskurve am kritischen Punkt endet.
- Die Freiheitsgrade innerhalb des Phasendiagramms sind von der betrachteten Ebene abhängig. Am Tripelpunkt und am kritischen Punkt existiert kein Freiheitsgrad, da sowohl Druck als auch Temperatur feste, lediglich stoffabhängige Werte besitzen. An den Phasengrenzlinien sind entweder Druck oder Temperatur frei wählbar und bedingen einander, es existiert folglich ein Freiheitsgrad. Im reinen Zustandsraum, also in den Flächen des Phasendiagramms, sind Druck und Temperatur frei wählbar, was zwei Freiheitsgraden entspricht.
Nichtklassische Aggregatzustände
Neben den drei klassischen Aggregatzuständen gibt es weitere Materiezustände, die zum Teil nur unter extremen Bedingungen auftreten (nach Temperatur, tendenziell von hoher zu niedriger, sortiert).
- Der Plasmazustand: Bei sehr hohen Temperaturen werden die Atome in Atomkern und -hülle zerlegt; freie Elektronen entstehen. Der Zustand tritt beispielsweise im Lichtbogen, in Sternen und in Kernfusionsreaktoren auf.
- Das Atomgas: In ihm existieren keine Moleküle mehr, da die ständigen Stöße die Bindungen zerstören, allerdings sind die Elektronen noch fest gebunden.
- Der überkritische Zustand tritt bei Überschreiten des kritischen Punktes auf und ist ein Mischzustand zwischen flüssig und gasförmig.
- Der mesomorphe Zustand: Er nimmt eine Zwischenposition zwischen den Aggregatzuständen flüssig und fest ein und tritt in verschiedener Ausprägung beispielsweise bei Flüssigkristallen oder plastischen Kristallen auf.
- Das Bose-Einstein-Kondensat: Hierbei handelt es sich um eine Menge extrem kalter Atome, die den gleichen quantenmechanischen Zustand einnehmen, dadurch ununterscheidbar werden und sich somit vollkommen kohärent verhalten.
- Das Fermionen-Kondensat: Ein superkalter Zustand von Fermionen, die sich durch ihren halbzahligen Spin von den Bosonen (ganzzahliger Spin) unterscheiden.
- Das Suprafluid: Eine Flüssigkeit ohne innere Reibung.
- Das Suprasolid: Ein Zustand, der bei superkaltem Helium-4 erreicht wird. Die Materie zeigt gleichzeitig Eigenschaften sowohl fester als auch suprafluider Körper.
- Der bosonische Metallzustand.[11]
Literatur
- Peter Kurzweil, Paul Scheipers: Chemie: Grundlagen, Aufbauwissen, Anwendungen und Experimente. Springer, 2010, ISBN 978-3-8348-0341-2 (eingeschränkte Vorschau in der Google-Buchsuche).
- Guido Kickelbick: Chemie für Ingenieure. Pearson Deutschland, 2008, ISBN 978-3-8273-7267-3 (eingeschränkte Vorschau in der Google-Buchsuche).
- B. Engels, C. Schmuck, T. Schirmeister, R. Fink: Chemie für Mediziner. Pearson Deutschland, 2008, ISBN 978-3-8273-7286-4 (eingeschränkte Vorschau in der Google-Buchsuche).
- Compact Silver Line: Physik: Grundwissen Formeln und Gesetze. Compact Verlag, 2010, ISBN 978-3-8174-7891-0 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieter Meschede, Christian Gerthsen: Gerthsen Physik. Springer, 2003, ISBN 978-3-540-02622-8 (eingeschränkte Vorschau in der Google-Buchsuche – über Plasma als den „Vierten Aggregatzustand“).
Weblinks
- Literatur von und über Aggregatzustand im Katalog der Deutschen Nationalbibliothek
- Flash-Animationen zu den Aggregatzuständen fest, flüssig, gasförmig (dwu-Unterrichtsmaterialien)
Einzelnachweise
- ↑ Iwan Gutzow, Jürn Schmelzer: The Vitreous State. Springer-Verlag, Berlin/Heidelberg 1995, ISBN 3-662-03189-2, S. 7, doi:10.1007/978-3-662-03187-2.
- ↑ Aggregatzustand. In: Lexikon der Physik. Abgerufen am 4. Februar 2021.
- ↑ Wolfgang Bechmann, Ilko Bald: Einstieg in die Physikalische Chemie für Naturwissenschaftler (= Studienbücher Chemie). 7. Auflage. Springer-Verlag, Berlin/Heidelberg 2020, ISBN 978-3-662-62033-5, Kapitel 1.1 Begriffe zur Beschreibung stofflicher Zustände, doi:10.1007/978-3-662-62034-2.
- ↑ Charles E. Mortimer, Ulrich Müller: Chemie: Das Basiswissen der Chemie. 13. Auflage. Georg Thieme Verlag, Stuttgart 2020, ISBN 978-3-13-242274-2, Kapitel 1.2 Elemente, Verbindungen, Gemische, doi:10.1055/b-006-163279.
- ↑ Ulrich Stroth: Plasmaphysik – Phänomene, Grundlagen und Anwendungen. 2. Auflage. Springer-Verlag, Berlin 2018, ISBN 978-3-662-55235-3, Kapitel 1 Einleitung, doi:10.1007/978-3-662-55236-0.
- ↑ David I. Bower: An introduction to polymer physics. Cambridge University Press, Cambridge 2002, ISBN 0-511-07757-2, 7.4 Time–temperature equivalence and superposition.
- ↑ Gert Strobl: The Physics of Polymers – Concepts for Understanding Their Structures and Behavior. 3. Auflage. Springer-Verlag, Berlin/Heidelberg 2007, ISBN 978-3-540-25278-8, 6.3 Specific Relaxation Processes and Flow Behavior, doi:10.1007/978-3-540-68411-4.
- ↑ J. B. Clark, J. W. Hastie, L. H. E. Kihlborg, R. Metselaar, M. M. Thackeray: Definitions of terms relating to phase transitions of the solid state (IUPAC Recommendations 1994). In: Pure and Applied Chemistry. Band 66, Nr. 3, 1. Januar 1994, ISSN 1365-3075, S. 577–594, doi:10.1351/pac199466030577.
- ↑ s für englisch solid
- ↑ l für englisch liquid
- ↑ Scinexx: Neuer Materialzustand im Supraleiter. (scinexx.de).
Auf dieser Seite verwendete Medien
Autor/Urheber: Minihaa, Lizenz: CC0
The picture shows the phase transition of water. The description is in German.
Autor/Urheber: Julio Miguel A Enriquez and Monica Muñoz, Lizenz: CC BY-SA 4.0
Animierte Darstellung der Bewegung der Atome oder Moleküle der Materie im Gaszustand, erstellt von Studenten des Tecnológico de Monterrey im Rahmen des Wiki Learning Tec de Monterrey, Mexiko-Stadt, Mexiko
Häufigkeitsverteilung der Aggregatzustände (fest≔blau, flüssig≔rot, gasförmig≔grün) der chemischen Elemente (bis Curium) in Abhängigkeit von der Temperatur; deutsche Skalenbeschriftung
Autor/Urheber: Julio Miguel A Enriquez and Monica Muñoz, Lizenz: CC BY-SA 4.0
Animierte Darstellung der Bewegung der Atome oder Moleküle der Materie im Flüssigzustand, erstellt von Studenten des Tecnológico de Monterrey im Rahmen des Wiki Learning Tec de Monterrey, Mexiko-Stadt, Mexiko
Die Abbildung zeigt die schematischen Phasendiagramme eines Stoffes ohne Dichteanomalie (oben) und des Wassers.
(c) Kaneiderdaniel, CC BY-SA 3.0
Teilchemodellbild eines flüssigen Stoffes
(c) Kaneiderdaniel, CC BY-SA 3.0
Teilchenmodellbild eines festen Stoffes
Autor/Urheber: F l a n k e r, penubag, Lizenz: CC0
Überblick über die Aggregatzustände
Autor/Urheber: Julio Miguel A Enriquez and Monica Muñoz, Lizenz: CC BY-SA 4.0
Animierte Darstellung der Bewegung der Atome oder Moleküle der Materie im Festzustand, erstellt von Studenten des Tecnológico de Monterrey im Rahmen des Wiki Learning Tec de Monterrey, Mexiko-Stadt, Mexiko















