Acebutolol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
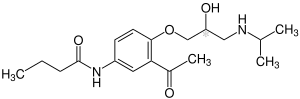 | ||||||||||||||||||||||
| 1:1-Gemisch von zwei Stereoisomeren – vereinfachte Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Acebutolol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C18H28N2O4 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | C07AB04 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | Blockade von β-Rezeptoren mit geringer β1-Selektivität und vorhandener intrinsischer Aktivität | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 336,43 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten |
| |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Acebutolol ist eine organische chemische Verbindung, die zu den Aromaten und Amiden zählt. Die Substanz wird als Arzneistoff der Gruppe der Betablocker eingesetzt.
Darstellung und Gewinnung
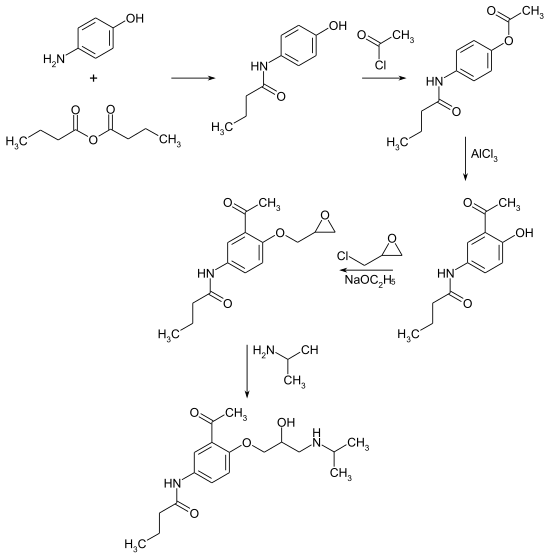
Die Herstellung von Acebutolol erfolgt in fünf Schritten.[4][5] Die Synthese geht vom 4-Aminophenol aus, dass im ersten Schritt mit Buttersäureanhydrid zum Säureamid 4-Butyramidophenol[6] und im zweiten Schritt mit Acetylchlorid zum O-Acetyl-4-butyramidophenol umgesetzt wird. Nach der Isomerisierung (Fries-Umlagerung) der Phenylacetatstruktur zur 2-Hydroxyacetophenonstruktur bei 140 °C in Gegenwart von Aluminiumchlorid erfolgt eine Veretherung mit Epichlorhydrin. Die Zielverbindung ergibt sich durch die Ringöffnung der Epoxyfunktion mit Isopropylamin. Die Synthesesequenz ergibt das Racemat.
Klinische Angaben
Acebutolol gehört zu der Gruppe der mittellangwirksamen Betablocker, mit einer Halbwertszeit von 4 bis 12 Stunden und einer Wirkdauer von bis zu 24 Stunden. Die Bioverfügbarkeit von Acebutolol beträgt 60 % und es weist eine geringe Selektivität für β1-Adrenozeptoren gegenüber anderen β-Adrenozeptoren auf. Es wird über die Niere ausgeschieden und sollte daher nicht bei Patienten mit Niereninsuffizienz gegeben werden.
Intrinsische sympathominetische Aktivität
Die Besonderheit von Acebutolol und einigen anderen Betablockern (Oxprenolol und Pindolol) besteht in der intrinsischen sympathomimetischen Aktivität (ISA).
Sonstige Informationen
Stereochemie
Acebutolol hat ein chirales Zentrum, arzneilich verwendet wird das Racemat. Die beiden Enantiomere eines chiralen Arzneistoffes zeigen fast immer eine unterschiedliche Pharmakologie und Pharmakokinetik, was früher aus Unkenntnis stereochemischer Zusammenhänge oft ignoriert wurde.[7] Das aktive Stereoisomer (Eutomer) ist (S)-Form von Acebutolol.[8]
| Enantiomere von Acebutolol | |
|---|---|
 CAS-Nr.: 68107-81-3 |  CAS-Nr.: 68107-82-4 |
Literatur
- T. Karow / R. Lang-Roth Allgemeine und spezielle Pharmakologie und Toxikologie 2003 S. 62 – 66.
- G. Herold Innere Medizin 2004.
Einzelnachweise
- ↑ Eintrag zu Acebutolol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ a b Datenblatt Acebutolol hydrochloride bei Sigma-Aldrich, abgerufen am 30. Mai 2022 (PDF).
- ↑ Eintrag zu Acebutolol in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b c d e f g h i j k l m A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications, 4. Auflage (2000), Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9
- ↑ Patent GB 1247384 (May & Baker, 1967).
- ↑ Verma, K.K.; Tyagi, P.: in Anal. Chem. 56 (1984) 2157.
- ↑ E. J. Ariëns (1984): Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology. In: European Journal of Clinical Pharmacology. 26(2); 663–668; PMID 6092093.
- ↑ Joni Agustiana, Azlina Harun Kamaruddina, Subhash Bhatiaa: Single enantiomeric -blockers—The existing technologies, Process Biochemistry 45 (2010) 1587–1604.
Handelsnamen
Prent (D)
Acebutolol in Kombination mit Mefrusid: Sali-Prent (D), Acebutolol in Kombination mit Nifedipin: Tredalat (D)
Auf dieser Seite verwendete Medien
Structural Formula of (RS)-Acebutolol
Structural Formula of (S)-Acebutolol
Synthese von Acebutolol
Structural Formula of (R)-Acebutolol