Variation der Geschlechtsentwicklung durch 5α-Reduktase-2-Mangel

5α-Reduktase-2-Mangel ist eine autosomal rezessive Erbkrankheit des Menschen, die zu einer Varianz der Geschlechtsentwicklung führen kann. Zugrunde liegt ein Defizit des Enzyms Steroid-5α-Reduktase Typ 2. Betroffene genetisch männliche (XY-) Menschen weisen einen selten männlichen, geschlechtlich unklaren bis zu überwiegend weiblichen Phänotyp auf. Genetisch weibliche (XX) Betroffene bilden keine Symptome aus (geschlechtslimitierte Phänotyp-Ausprägung).
Synonyme sind: 5-Alpha-Reduktase-Mangel; 46,XY DSD durch 5-Alpha-Reduktase-2-Mangel; Pseudohermaphroditismus, männlicher, durch 5-Alpha-Reduktase-2-Mangel; Pseudovaginale perineoskrotale Hypospadie; Steroid-5-Alpha-Reduktase-2-Mangel. Nach der Erstautorin J. Imperato-McGinley wird diese Variation der Geschlechtsentwicklung bei Menschen mit XY-Chromosomen auch als Imperato-McGinley-Syndrom bezeichnet.[1]
Auffällig ist ein regionales Auftreten von 5α-Reduktase-2-Mangel besonders in der Dominikanischen Republik wie auch in der Türkei, Mexiko, Ägypten und Neuguinea.[2][3]
Krankheitsbild
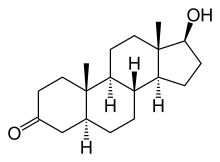
Die 5α-Reduktase (SRD5) wandelt in den Zielzellen das Geschlechtshormon Testosteron in seine biologisch aktivste Form Dihydrotestosteron (DHT) um. Diese Form gehört zu den Androgenen und ihre Wirkung am betreffenden Androgenrezeptor ist wesentlich stärker als diejenige von Testosteron. Das DHT ist unter anderem für die Bildung der inneren und äußeren männlichen Geschlechtsteile während der Embryonalentwicklung im Mutterleib zuständig.
Unterbleibt durch einen Mangel der Steroid-5α-Reduktase (insbesondere des zweiten Isozyms SRD5A2) die Umwandlung von Testosteron zu DHT, so kann es während der Schwangerschaft bei Föten mit XY-Chromomen zur Bildung einer Hypospadie des Penis kommen, bei dem die äußere Öffnung der Harnröhre im Dammbereich liegt.[4] Bei Föten mit XX-Chromosomen hat der Enzymmangel keinen Einfluss auf die Entwicklung des Körpers.
Biochemisch ist die Testosteron-Konzentration bei Betroffenen niedrig bis normal. Der DHT-Spiegel ist sehr niedrig. Das Verhältnis von Testosteron zu DHT ist somit höher als normal.
Symptome
Betroffene Menschen mit XY-Chromomen werden zwar mit Hoden geboren, diese sind allerdings in den ersten Jahren im Körperinneren verborgen (Kryptorchismus). Überwiegend finden sich weibliche äußere Genitalien mit vergrößerter Klitoris oder nur ein kleiner Penis, der mit einer Hypospadie unterschiedlichen Ausmaßes einhergeht.
Beim Einsetzen der Pubertät kommt es dann zur vermehrten Ausschüttung des Sexualhormons Testosteron, und es folgt eine männliche Pubertät. Die bislang im Körperinneren verbliebenen Hoden steigen ab und treten nach außen in einen sich bildenden Hodensack. Die zuvor meist uneindeutige Klitoris oder Mikrophallus vergrößert sich.[5][6]
Genetik
Zugrunde liegende Mutationen des 5α-Reduktase-2-Gens (SRD5A2-Gens)[7][8] sind vielfältig, betreffen aber gehäuft die Genabschnitte Exon 2 und Exon 4[9]. Neben homozygoten Mutationen treten auch unterschiedliche Mutationen in beiden Allelen (Compound-Heterozygotie) auf.[10]
Soziales
In dem abgelegenen Dorf Las Salinas in der Dominikanischen Republik wurde 1974 ein Auftreten in 12 von 13 Familien belegt. Einer von 90 Männern war betroffen. Alle diese Fälle ließen sich auf einen gemeinsamen direkten Vorfahren zurückverfolgen, weswegen ein Gründereffekt diskutiert wurde.[11] Aus dem Dorf Salinas stammt auch der Begriff Guevedoche oder Guevedoces, was im Spanischen so viel wie „Eier mit 12“ bedeutet (guevas ist ein umgangssprachlicher Ausdruck für Hoden, doce bedeutet zwölf). Manchmal wird sowohl im Englischen als auch auf Deutsch die Erklärung „Penis mit Zwölf“ verwendet. Auch der Begriff Machihembras (buchstäblich „männlich-weiblich“) ist gebräuchlich.[12]
Kinder mit XY-Chromomen und 5α-Reduktase-2-Mangel werden häufig als Mädchen aufgezogen.[13] Manche von ihnen entwickeln eine weibliche Geschlechtsidentität, wohingegen andere zu einem männlichen Geschlecht transitionieren.[13][10]
Literatur
- Elaine M. F. Costa, Sorahia Domenice, Maria Helena Sircili, Marlene Inacio, Berenice B. Mendonca: DSD Due to 5α-Reductase 2 Deficiency - from Diagnosis to Long Term Outcome. In: Seminars in Reproductive Medicine. Oktober 2012, Band 30, Nr. 5, S. 427–431, doi:10.1055/s-0032-1324727 (Volltext).
Einzelnachweise
- ↑ P. Hertoft, T. Sørensen: Transsexuality: Some remarks based on clinical experience. In: R. Porter, J. Whelan (Hrsg.): Sex, Hormones and Behaviour (= Ciba Foundation Symposium. Band 62). Exzerpt Medica, Amsterdam, Oxford, New York 1979, ISBN 90-219-4068-X, S. 192 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Elaine M. F. Costa, Sorahia Domenice, Maria Helena Sircili, Marlene Inacio, Berenice B. Mendonca: DSD Due to 5α-Reductase 2 Deficiency - from Diagnosis to Long Term Outcome. In: Seminars in Reproductive Medicine. Oktober 2012, Band 30, Nr. 5, S. 427–431, doi:10.1055/s-0032-1324727.
- ↑ Hey-Joo Kang, Julianne Imperato-McGinley, Yuan-Shan Zhu, Zev Rosenwaks: The effect of 5α-reductase-2 deficiency on human fertility. In: Fertility and sterility. Band 101, Nr. 2, Januar 2014, S. 310–316, doi:10.1016/j.fertnstert.2013.11.128; Kapitel: Gender Identity and Gender Role.
- ↑ Online Mendelian Inheritance in Man (OMIN) - Victor A. McKusick: #264600; PSEUDOVAGINAL PERINEOSCROTAL HYPOSPADIAS; PPSH. Auf: omim.org vom 4. Juni 1986, reorganisiert: 18. Oktober 2002; zulatzt abgerufen am 15. November 2020.
- ↑ Julianne Imperato-McGinley, Yuan-Shan Zhu: Androgens and male physiology—The syndrome of 5 alpha-reductase-2 deficiency. In: Molecular and Cellular Endocrinology. Band 19, Nr. 1, Dezember 2002, S. 51–59, doi:10.1016/S0303-7207(02)00368-4 (Volltext).
- ↑ Hey-Joo Kang, Julianne Imperato-McGinley, Yuan-Shan Zhu, Zev Rosenwaks: The effect of 5α-reductase-2 deficiency on human fertility. In: Fertility and sterility. Band 101, Nr. 2, Januar 2014, S. 310–316, doi:10.1016/j.fertnstert.2013.11.128 (Volltext).
- ↑ The National Center for Biotechnology Information (NBC): Gene 6716 (uid); SRD5A2 steroid 5 alpha-reductase 2; Homo sapiens (human). Auf: ncbi.nlm.nih.gov; aktualisiert: 2. September 2020, zuletzt abgerufen am 15. November 2020.
- ↑ UCSC Genome Informatics Group - Online Mendelian Inheritance in Man (OMIN): OMIM genes - 607306. Auf: genome.ucsc.edu, aktualisiert: 11. November 2020; zuletzt abgerufen am 15. November 2020.
- ↑ Bild: Mutationen im SRD5A2-Gen auf: marlin-prod.literatumonline.com; abgerufen am 23. Februar 2019.
- ↑ a b L. Maimoun, P. Philibert, B. Cammas et al.: Phenotypical, biological, and molecular heterogeneity of 5alpha-reductase deficiency: an extensive international experience of 55 patients. In: The Journal of clinical endocrinology and metabolism. Band 96, Nummer 2, Februar 2011, S. 296–307, ISSN 1945-7197, doi:10.1210/jc.2010-1024, PMID 21147889.
- ↑ J. Imperato-McGinley, L. Guerrero, T. Gautier, R. E. Peterson: Steroid 5alpha-reductase deficiency in man: an inherited form of male pseudohermaphroditism. In: Science. Band 186, Nummer 4170, Dezember 1974, S. 1213–1215, ISSN 0036-8075, PMID 4432067.
- ↑ The 'Guevedoces' of the Dominican Republic. Urological Sciences Research Foundation. abgerufen am 22. Februar 2013.
- ↑ a b 5-alpha reductase deficiency: MedlinePlus Genetics. Abgerufen am 9. Juli 2023 (englisch).
Weblinks
- Variation der Geschlechtsentwicklung durch 5α-Reduktase-2-Mangel. In: Orphanet (Datenbank für seltene Krankheiten).
- Gene oder Gesellschaft? Was trennt Mann und Frau wirklich voneinander? Ein Gespräch mit dem Verhaltensforscher Irenäus Eibl-Eibesfeldt. Online-Auftritt der Süddeutschen Zeitung, abgerufen am 26. Februar 2013
- Variation der Geschlechtsentwicklung durch 5α-Reduktase-2-Mangel. In: Online Mendelian Inheritance in Man. (englisch)
Auf dieser Seite verwendete Medien
Autor/Urheber: CM Broere, Lizenz: CC BY-SA 3.0
Biochemistry; testosterone biosynthesis, pathology in 5alpha-reductase deficiency
Structural diagram of dihydrotestosterone (INN: androstanolone). Created using ACD/ChemSketch 8.0 and Inkscape.

