11-Aminoundecansäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 11-Aminoundecansäure | ||||||||||||||||||
| Andere Namen | ω-Aminoundecansäure | ||||||||||||||||||
| Summenformel | C11H23NO2 | ||||||||||||||||||
| Kurzbeschreibung | weißes kristallines Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 201,31 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 1,1720 g·cm−3 (26,1 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Dampfdruck | 2,07·10−7(1013 Pa) bei 25 °C[3] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
11-Aminoundecansäure ist eine längerkettige gesättigte Aminosäure mit endständiger Aminogruppe. Sie ist über mehrere chemische Reaktionsstufen aus dem als Nahrungsmittel ungeeigneten Rizinusöl zugänglich und damit ein nicht in Nutzungskonkurrenz zwischen nachwachsenden Rohstoffen und Lebensmitteln stehender Monomerbaustein für Polyamid 11.
Darstellung
Die von dem französischen Chemieunternehmen Arkema entwickelte Synthese der 11-Aminoundecansäure verläuft in vier separaten Teilschritten:[5]
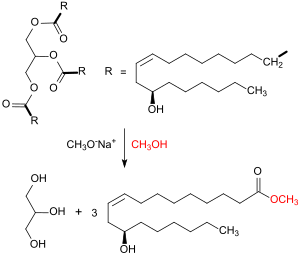
1. Umesterung des Rizinusöls zu Methylricinoleat
Rohes Rizinusöl besteht zu ca. 90 % aus dem Triglycerid der Ricinolsäure und wird durch Zuführung einer Mischung mit Methanol im Verhältnis 1:3 in einen Rührreaktor in Gegenwart des basischen Umesterungskatalysators Natriummethanolat bei 80 °C innerhalb 1 h Reaktionszeit quantitativ zu Methylricinoleat – dem Methylester der Ricinolsäure – umgesetzt. Zu Reaktionsende setzt sich das entstehende Glycerin ab, der flüssige Methylester wird zur Entfernung von Glycerinresten mit Wasser gewaschen.
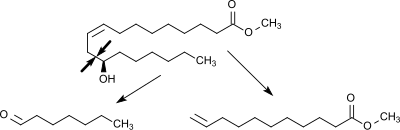
2. Pyrolyse des Methylricinoleats zu Heptanal und Methylundecenoat
Methylricinoleat wird bei 250 °C verdampft, mit 600 °C heißem Wasserdampf im Verhältnis 1:1 gemischt und in einem Spaltofen bei 400–575 °C bei einer Verweilzeit von ca. 10 Sekunden in die Spaltprodukte Heptanal und Methylundecenoat zerlegt. Die Spaltung der aliphatischen Kette erfolgt bei dieser Variante des Steamcrackens selektiv zwischen der Hydroxymethylen- und der allylständigen Methylengruppe. Außerdem fällt ein Gemisch von Methylestern gesättigter und ungesättigter C18-Carbonsäuren an, das unter dem Namen Esterol® u. a. als Schmierstoffadditiv Anwendung findet.
3. Hydrolyse des Methylundecenoats zur 10-Undecensäure
Die Verseifung des Methylesters mit Natronlauge verläuft bei 25 °C innerhalb von 30 min mit quantitativer Ausbeute. Nach Ansäuern mit Salzsäure fällt feste 10-Undecensäure (Undecylensäure) an.

4. Hydrobromierung der 10-Undecensäure zur 11-Bromundecansäure
Die Undecensäure wird in Toluol gelöst und in Gegenwart des Radikalstarters Benzoylperoxid (BPO) gasförmiger Bromwasserstoff entgegen der Markownikow-Regel ("Anti-Markownikow") radikalisch addiert. Die schnelle und stark exotherme Reaktion liefert bei Kühlung auf 0 °C in 95 %iger Ausbeute 11-Bromundecansäure – als Nebenprodukt entsteht in geringer Menge das Markownikow-Produkt 10-Bromundecansäure. Das Toluol und nicht-reagierter Bromwasserstoff werden im Vakuum abgezogen und recycliert.

5. Bromaustausch in der 11-Bromundecansäure zu 11-Aminoundecansäure
Die 11-Bromundecansäure wird bei 30 °C mit einem großen Überschuss an 40 %iger wässriger Ammoniak-Lösung versetzt. Nach Beendigung der Reaktion wird Wasser zugesetzt und das Gemisch zum Austreiben des überschüssigen Ammoniaks auf 100 °C erhitzt, abgekühlt, kristallisiert und abzentrifugiert.
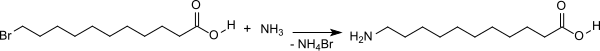
Die Säure kann aus Wasser umkristallisiert werden. Zur weiteren Reinigung kann das durch Ansäuern mit Salzsäure erhältliche Hydrochlorid der 11-Aminoundecansäure aus einem Methanol/Ethylacetat-Gemisch umkristallisiert werden.[6]
Eigenschaften
11-Aminoundecansäure ist ein weißer kristalliner und geruchloser Feststoff mit geringer Löslichkeit in Wasser.
Verwendung
Die durch Acylierung von 11-Aminoundecansäure mit Chloracetylchlorid entstehende Chloracetylamino-11-undecansäure wirkt als Fungizid und Insektizid gegen Pflanzenschädlinge.[7]
N-Acylderivate der 11-Aminoundecansäure in Form oligomerer Amide besitzen bemerkenswerte Eigenschaften als Geliermittel für Wasser und organische Lösungsmittel.[8]
Monomerbaustein für Polyamid 11
Die mit Abstand wichtigste Verwendung von 11-Aminoundecansäure ist sein Einsatz als Monomerbaustein für Polyamid 11 (Nylon-11, Rilsan®). Wallace Hume Carothers, der Erfinder des Polyamids (Nylon 66) soll 11-Aminoundecansäure bereits 1931 polymerisiert haben.[9]

Polyamid 11 ist zwar von einem nachwachsenden Rohstoff abgeleitet, d. h. biobasiert, aber dennoch nicht biologisch abbaubar. Es besitzt das vorteilhafteste Ökoprofil vergleichbarer thermoplastischer Kunststoffe.[10] Wegen seiner exzellenten Zähigkeit bei niedrigen Temperaturen ist Polyamid 11 bereits bei −70 °C einsetzbar. Seine relativ unpolare Molekülstruktur infolge der geringen Dichte an Amidbindungen im Molekül führt zu einer im Vergleich zu Polyamid 6 und Polyamid 66 niedrigen Feuchtigkeitsaufnahme. Darüber hinaus besitzt Polyamid 11 eine sehr gute chemische Stabilität, z. B. gegenüber Kohlenwasserstoffen, eine niedrige Dichte, gute thermische Stabilität und Witterungsbeständigkeit und ist leicht zu verarbeiten.
Einzelnachweise
- ↑ a b c d Datenblatt 11-Amino-undecansäure bei Sigma-Aldrich, abgerufen am 29. Dezember 2013 (PDF).
- ↑ a b Eintrag zu 11-Aminoundecansäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Dezember 2013. (JavaScript erforderlich)
- ↑ a b c GPS Safety Report: 11-aminoundecanoic acid
- ↑ a b OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Undecanoic acid, 11-amino-, abgerufen am 28. Oktober 2014.
- ↑ A. Chauvel, G. Lefebvre, Petrochemical Processes: Technical and Economic Characteristics, Band 2, S. 277, Editions Technip, Paris, 1989, ISBN 2-7108-0563-4
- ↑ M.-H. Koh et al.: Divergent process for C10, C11, and C12 α-amino acid and α,ω-dicarboxylic acid monomers of polyamides from castor oil as a renewable resource. In: Bull. Korean Chem. Soc., 33 (6), 1873–1878 (2012), doi:10.5012/bkcs.2012.33.6.1873.
- ↑ Patent US4055663: Halogenated acylamino acids as fungicides. Angemeldet am 27. Juni 1974, veröffentlicht am 25. Oktober 1977, Erfinder: Sol J. Barer et al., abgetreten an National Patent Development Corp..
- ↑ A. D’Aleo et al., 11-Aminoundecanoic acid: a versatile unit for the generation of low molecular weight gelators for water and organic solvents, Chem. Commun., 2004, 190–191, doi:10.1039/B307846A.
- ↑ Renewable Polymers: Synthesis, Processing, and Technology, edited by V. Mittal, J. Wiley & Sons, Hoboken, NJ, ISBN 978-0-470-93877-5
- ↑ Jim Mason:Rilsan Polyamide-11 - A success story for sustainable resource based engineering thermoplastics ( vom 4. Dezember 2016 im Internet Archive), 9. April 2008.
Auf dieser Seite verwendete Medien
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
Hydrolysis of 11-undecenoic acid methyl ester
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
Ricinoic acid methyl ester pyrolysis
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
Transesterification of castor oil
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
Polycondensation of 11-Aminoundecanoic acid to Nylon 11
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
11-aminoundecenoic acid structure
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 3.0
11-Aminoundecanoic acid synthesis






