Xanthinoxidase
| Xanthinoxidase | ||
|---|---|---|
 | ||
| Bändermodell des Monomer der Xanthinoxidase aus Rind, pdb 1FIQ. Gebundene Cofaktoren, FAD (rot), FeS-cluster (orange), Molybdän-Cofactor mit Molybdän (gelb) und der gebundene Inhibitor Salicylat (blau), sind hervorgehoben. | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 146 kDa / 1332 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | 2 (2Fe-2S), FAD, Molybdopterin | |
| Bezeichner | ||
| Gen-Namen | XDH ; XO; XS; XDHA | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.17.3.2, Oxidoreduktase | |
| Reaktionsart | Hydroxylierung | |
| Substrat | Xanthin + H2O + O2 | |
| Produkte | Harnsäure + H2O2 | |
| Vorkommen | ||
| Homologie-Familie | Xanthindehydrogenase | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 7498 | 22436 |
| Ensembl | ENSG00000158125 | ENSMUSG00000024066 |
| UniProt | P47989 | Q00519 |
| Refseq (mRNA) | NM_000379 | NM_011723 |
| Refseq (Protein) | NP_000370 | NP_035853 |
| Genlocus | Chr 2: 31.33 – 31.41 Mb | Chr 17: 73.88 – 73.95 Mb |
| PubMed-Suche | 7498 | 22436 |
Die Xanthinoxidase (XO, manchmal auch XAO) oder Xanthindehydrogenase (XDH) ist ein Metalloenzym (eine Hydroxylase), welches die Oxidation von Hypoxanthin und Xanthin zu Harnsäure in Niere und Leber katalysiert.
Oxidation von Hypoxanthin zu Xanthin:
Oxidation von Xanthin zu Harnsäure:
Das aktive Zentrum enthält ein Molybdänatom, gebunden in Form des Molybdän-Cofaktors (MoCo). Jede Untereinheit enthält zudem zwei unterscheidbare Zwei-Eisen-zwei-Schwefel-Cluster (2Fe-2S) und ein FAD-Molekül. In Prokaryoten werden die MoCo-, (2Fe-2S)- und FAD-Domäne von zwei bzw. drei Genen kodiert, in Eukaryoten sind die Domänen in einem Gen fusioniert. Das Enzym kommt daher in Eukaryoten als Homodimer vor, in Prokaryoten als Heterotetramer bzw. Heterohexamer.
Erhöhter Harnsäurespiegel ist als Gicht bekannt. Gicht kann daher auch mit einem Inhibitor der Xanthinoxidase behandelt werden; zum Beispiel Allopurinol oder Febuxostat. Allopurinol bindet sich fest an die reduzierte Form der Xanthinoxidase und inaktiviert sie somit. Dadurch wird die Produktion der schwerlöslichen Harnsäure verringert und die Konzentration der besser löslichen Verbindungen Xanthin und Hypoxanthin erhöht.
Literatur
- J. J. Truglio et al.: Crystal structures of the active and alloxanthine-inhibited forms of xanthine dehydrogenase from Rhodobacter capsulatus. Structure. 10/1/2002:115-25. PMID 11796116
- L. G. Nagler und L. S. Vartanyan: Subunit structure of bovine milk xanthine oxidase. Effect of limited cleavage by proteolytic enzymes on activity and structure. Biochim Biophys Acta. 427/1/1976:78-90-PMID 1260010
- S. T. Smith et al.: Purification and properties of xanthine dehydroganase from Micrococcus lactilyticus. J Biol Chem. 242/18/1976:4108-4117. PMID 6061702
Weblinks
Auf dieser Seite verwendete Medien
Struktur von Hypoxanthinen: structure of hypoxanthine
Struktur von Harnsäure (Ketoform)
Autor/Urheber: Yikrazuul, Lizenz: CC BY-SA 3.0
Kristallstruktur (Monomer) der Xanthinoxidase aus Rind, pdb 1FIQ. Gebundene Cofaktoren, FAD (rot), FeS-cluster (orange), the molybdopterin cofactor with molydenium (gelb) and the salicylate (blau), sind hervorgehoben.
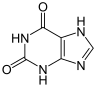
Struktur von Xanthin