Organische Chemie

Die organische Chemie (kurz OC oder häufig auch Organik) ist ein Teilgebiet der Chemie. Darin werden die chemischen Verbindungen behandelt, die auf Kohlenstoff basieren, abgesehen von einigen Ausnahmen wie manchen anorganischen Kohlenstoffverbindungen und dem elementaren (reinen) Kohlenstoff.
Die große Bindungsfähigkeit des Kohlenstoffatoms ermöglicht eine Vielzahl von unterschiedlichen Bindungen zu anderen Atomen. Während viele anorganische Stoffe durch Temperatureinfluss und katalytische Reagenzien nicht verändert werden, finden organische Reaktionen oft bei Raumtemperatur oder leicht erhöhter Temperatur mit katalytischen Mengen an Reagenzien statt. Auch die Entstehung der Vielzahl der Naturstoffe (pflanzliche, tierische Farbstoffe, Zucker, Fette, Proteine, Nukleinsäuren) und letztlich der bekannten Lebewesen basiert auf dieser Bindungsfähigkeit.
Organische Moleküle enthalten als Elemente neben Kohlenstoff häufig Wasserstoff, Sauerstoff, Stickstoff, Schwefel, Halogene; die chemische Struktur und die funktionellen Gruppen sind die Grundlage für die Verschiedenartigkeit der Einzelmoleküle.
In der organischen Analytik erfolgt zunächst aus einem Gemisch von Stoffen eine physikalische Trennung und Charakterisierung (Schmelzpunkt, Siedepunkt, Brechungsindex) von Einzelstoffen, dann werden die elementare Zusammensetzung (Elementaranalyse), Molekülmasse und funktionellen Gruppen (mit Hilfe von chemischen Reagenzien, NMR-, IR- und UV-Spektroskopie) bestimmt.
Untersucht wird die Einwirkung von Reagenzien (Säuren, Basen, anorganischen und organischen Stoffen) auf organische Stoffe, um Gesetzmäßigkeiten von chemischen Reagenzien auf bestimmte funktionelle Gruppen und Stoffgruppen zu bestimmen.
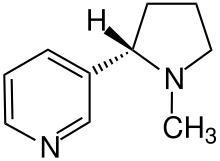
Die organische Chemie synthetisiert organische Naturstoffe (z. B. Zucker, Peptide, Naturfarbstoffe, Alkaloide, Vitamine) ebenso wie in der Natur unbekannte organische Stoffe (Kunststoffe, Ionenaustauscher, Arzneistoffe, Pflanzenschutzmittel, Kunstfasern für Kleidungsstücke).
Die Entwicklungen der organischen Chemie hatten in den letzten 150 Jahren einen bedeutenden Einfluss auf die menschliche Gesundheit, die Ernährung, die Kleidung und die Vielfalt der verfügbaren Konsumgüter. Sie trug in großem Maße zum Wohlstand der Menschheit bei.
Abgrenzung zur anorganischen Chemie
Mit wenigen Ausnahmen umfasst die Organik die Chemie aller Verbindungen, die der Kohlenstoff mit sich selbst und anderen Elementen eingeht. Dazu gehören auch alle Bausteine des derzeit bekannten Lebens. Im Jahre 2012 waren etwa 40 Millionen organische Verbindungen bekannt.
Die Ausnahmen betreffen formal zunächst die elementaren Formen des Kohlenstoffs (Graphit, Diamant) sowie systematisch alle Verbindungen ohne jede atomare Kohlenstoff-Wasserstoff-Bindung, wie zur anorganischen Chemie zählenden wasserstofffreien Chalkogenide des Kohlenstoffs (Kohlenstoffmonoxid, Kohlenstoffdioxid, Schwefelkohlenstoff), die Kohlensäure und Carbonate, die Carbide sowie die ionischen Cyanide, Cyanate und Thiocyanate (siehe Kohlenstoff-Verbindungen).
Die Blausäure gehört zum Grenzgebiet der anorganischen und organischen Chemie. Obwohl man sie traditionell zur anorganischen Chemie zählen würde, wird sie als Nitril (organische Stoffgruppe) der Ameisensäure aufgefasst. Die Cyanide werden in der Anorganik behandelt, wobei hier nur die Salze der Blausäure gemeint sind, wohingegen die unter selbigem Namen bekannten Ester als Nitrile zur Organik gehören. Auch die Cyansauerstoffsäuren, Thiocyansäuren und deren Ester gelten als Grenzfälle. Weiter ist die metallorganische Chemie (Metallorganyle) nicht konkret der organischen oder anorganischen Chemie zuzuordnen.
Auch völlig unnatürlich wirkende Stoffe, wie Kunststoffe und Erdöl, zählen zu den organischen Verbindungen, da sie wie Naturstoffe aus Kohlenstoffverbindungen bestehen. Erdöl, Erdgas und Kohle, die Ausgangsstoffe für viele synthetische Produkte, sind letztlich organischen Ursprungs.
Alle Lebewesen enthalten organische Stoffe wie Aminosäuren, Proteine, Kohlenhydrate und die DNA. Das Teilgebiet der organischen Chemie, das sich mit den Stoffen und Stoffwechselprozessen in Lebewesen befasst, ist die Biochemie (oder auch Molekularbiologie).
Allgemeines
Die Sonderstellung des Kohlenstoffs beruht darauf, dass das Kohlenstoffatom vier Bindungselektronen hat, wodurch es unpolare Bindungen mit ein bis vier weiteren Kohlenstoffatomen eingehen kann. Dadurch können lineare oder verzweigte Kohlenstoffketten sowie Kohlenstoffringe entstehen, die an den nicht mit Kohlenstoff besetzten Bindungselektronen mit Wasserstoff und anderen Elementen (vorwiegend Sauerstoff, Stickstoff, Schwefel, Phosphor) verbunden sind, was zu großen und sehr großen Molekülen (z. B. Homo- und Heteropolymere) führen kann und die riesige Vielfalt an organischen Molekülen erklärt. Von dem ebenfalls vierbindigen Silicium gibt es auch eine große Anzahl Verbindungen, aber bei Weitem keine solche Vielfalt.
Die Eigenschaften organischer Substanzen werden sehr stark von ihrer jeweiligen Molekülstruktur bestimmt. Selbst die Eigenschaften von einfachen organischen Salzen wie den Acetaten werden deutlich von der Molekülform des organischen Teils geprägt. Es gibt auch viele Isomere, das sind Verbindungen mit der gleichen Gesamtzusammensetzung (Summenformel), aber unterschiedlicher Struktur (Strukturformel).
Dagegen bestehen die Moleküle in der anorganischen Chemie meist nur aus einigen wenigen Atomen, bei denen die allgemeinen Eigenschaften von Festkörpern, Kristallen und/oder Ionen zum Tragen kommen. Es gibt aber auch Polymere, die keinen Kohlenstoff enthalten (oder nur in Nebengruppen), z. B. die Silane.
Organische Synthesestrategien unterscheiden sich von Synthesen in der anorganischen Chemie, da organische Moleküle meist Stück für Stück aufgebaut werden können. Etwa 60 % der Chemiker in Deutschland und den USA haben als Schwerpunktfach die organische Chemie gewählt.
Geschichte


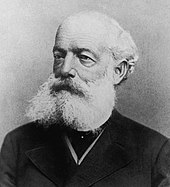
Viele organische Naturstoffe wurden schon in der Frühzeit der menschlichen Entwicklung genutzt (die Farbstoffe Indigo, Alizarin, die ätherischen Öle, Weingeist). Eine künstliche Darstellung von organischen Stoffen durch Menschenhand ist jedoch in sehr früher Zeit nicht beschrieben worden.
Johann Rudolph Glauber beschrieb in seinen Werken eine Vielzahl von selbst dargestellten organischen Verbindungen, da jedoch die Elementaranalyse noch nicht entwickelt war, kann nur vermutet werden, welche Stoffe er damals erhalten hatte. Weingeist und Essig reinigte Glauber über eine fraktionierte Destillation, Ethylchlorid erhielt er aus Weingeist,[1] Essigsäure aus der Holzdestillation,[2] Aceton aus der Erhitzung von Zinkazetat,[3] Acrolein entstand bei der Destillation von Rüben-, Nuss- und Hanföl,[4] Benzol aus Steinkohle,[5] Alkaloide fand er durch eine Salpetersäure-Trennung.[6]
Lemery schrieb 1675 das Buch Cours de Chymie. In diesem Werk wurden die Stoffe in drei Gebiete eingeteilt: Mineralreich (Metalle, Wasser, Luft, Kochsalz, Gips), Pflanzenreich (Zucker, Stärke, Harze, Wachs, Pflanzenfarbstoffe), Tierreich (Fette, Eiweiße, Hornsubstanzen). Lemery unterschied auch die Stoffe des Pflanzen- und Tierreiches als organische Stoffe im Gegensatz zu den Stoffen der unbelebten Natur des Mineralreiches.
Bereits im 18. Jahrhundert war eine beträchtliche Zahl von organischen Substanzen als Reinstoff isoliert worden. Beispiele hierfür sind der Harnstoff (1773 von Hilaire Rouelle) und viele Säuren, wie die von Ameisen erhaltene Ameisensäure (1749 von Andreas Sigismund Marggraf), die Äpfelsäure aus Äpfeln, und die aus dem Weinstein gewonnene Weinsäure (1769), die Citronensäure (1784), das Glycerin (1783), die Oxalsäure, die Harnsäure (von Carl Wilhelm Scheele).
Antoine Laurent de Lavoisier bestimmte erstmals qualitativ die in organischen Stoffen enthaltenen chemischen Elemente: Kohlenstoff, Wasserstoff, Sauerstoff, Stickstoff. Joseph Louis Gay-Lussac und Louis Jacques Thenard führten erste Elementaranalysen zur Ermittlung der quantitativen Zusammensetzung von Elementen in organischen Stoffen aus. Die Elementaranalyse wurde 1831 von Justus von Liebig verbessert.[7] Nun konnte die elementare Zusammensetzung von organischen Stoffen schnell bestimmt werden.
Jöns Jakob Berzelius stellte die These auf, dass organische Stoffe nur durch eine besondere Lebenskraft im pflanzlichen, tierischen oder menschlichen Organismus geschaffen werden können. Sein Büchlein Uebersicht der Fortschritte und des gegenwärtigen Standes der thierischen Chemie markierte 1810 den Beginn der in der ersten Hälfte des 19. Jahrhunderts sich herausbildenden organischen Chemie.[8] Berzelius wendete auch das Gesetz der multiplen Proportionen – mit dem er im Bereich der anorganischen Verbindungen Atomgewichte und Zusammensetzung, d. h. deren chemische Formeln, bestimmen konnte auch auf organische Verbindungen an.[9]
Die Struktur und Zusammensetzung von organischen Verbindungen war um 1820 noch sehr ungeklärt. Gay-Lussac glaubte, dass das Ethanol eine Verbindung aus einem Teil Ethen und einem Teil Wasser sei.
Weiterhin glaubten die Chemiker damals, dass bei gleicher qualitativer und quantitativer Zusammensetzung (Summenformel) der Elemente einer Verbindung (Elementaranalyse) die Stoffe auch identisch sein müssen. Erste Zweifel traten im Jahr 1823 auf als Justus von Liebig und Friedrich Wöhler das knallsaure Silber sowie das cyansaure Silber untersuchten. Sie fanden bei gleicher chemischer Zusammensetzung sehr unterschiedliche Stoffe.[10]

Im Jahr 1828 erhitzte Friedrich Wöhler Ammoniumcyanat und erhielt einen ganz andersartigen Stoff, den Harnstoff.[11] Ausgangsprodukt und Endprodukt haben die gleiche chemische Summenformel (Isomerie), sie besitzen jedoch sehr unterschiedliche Eigenschaften: das Ammoniumcyanat ist eine anorganische Verbindung, der Harnstoff ist eine organische Verbindung. Damit war die Hypothese von Berzelius, dass organische Verbindungen nur durch eine besondere Lebenskraft entstehen können, widerlegt.
Hermann Kolbe formulierte 1859 die These, dass alle organischen Stoffe Abkömmlinge der anorganischen Stoffe – insbesondere des Kohlenstoffdioxids – sind. So ergibt der Ersatz einer Hydroxygruppe durch Alkylreste oder Wasserstoff Carbonsäuren, der Ersatz zweier Hydroxygruppen durch Alkylgruppen oder Wasserstoff die Aldehyde, Ketone.[12] Kolbe gebrauchte auch das Wort Synthese im Zusammenhang mit der künstlichen Darstellung von organischen Naturstoffen. Chemiker konnten bald durch eigene Forschungen neue organische Moleküle synthetisieren.
In Analogie zu positiv und negativ geladenen Ionen in der anorganischen Chemie vermutete Berzelius sogenannte Radikale in der organischen Chemie; darauf basierte seine Radikaltheorie. Ein Radikalteil des organischen Moleküls sollte eine positive, der andere Teil eine negative Ladung besitzen. Einige Jahre später untersuchten Jean Baptiste Dumas, Auguste Laurent, Charles Gerhardt und Justus von Liebig die Substitution bei organischen Verbindungen. Die Wasserstoffatome in organischen Verbindungen wurden durch Halogenatome ersetzt. Die alte Radikaltheorie von Berzelius, nach der sich positiv und negativ geladene Radikalteile in organischen Molekülen zusammenlagern, musste verworfen werden. In der Folge wurde von August Wilhelm von Hofmann, Hermann Kolbe, Edward Frankland, Stanislao Cannizzaro weitere Grundlagen über die Zusammensetzung von organischen Stoffen gefunden. 1857 veröffentlichte Friedrich August Kekulé seine Arbeit „Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radikale“ in Liebigs Annalen der Chemie,[13] die als Ausgangspunkt der organischen Strukturchemie gesehen wird. In dieser Arbeit wird der Kohlenstoff erstmals als vierwertig beschrieben.
Adolf von Baeyer, Emil Fischer, August Wilhelm von Hofmann erforschten Synthesen von Farbstoffen, Zuckern, Peptiden und Alkaloiden.
Ein Großteil der Arbeitszeit der früheren Chemiker lag in der Isolierung eines Reinstoffes.
Die Prüfung der Stoffidentität von organischen Stoffen erfolgte über Siedepunkt, Schmelzpunkt, Löslichkeit, Dichte, Geruch, Farbe, Brechungsindex.
Besonders wichtig wurde der Rohstoff Kohle für die organische Chemie. Ihren Aufschwung nahm die organische Chemie mit der Untersuchung der bei der Leuchtgaserzeugung entstehenden Abfallprodukte, als der deutsche Chemiker Friedlieb Ferdinand Runge (1795–1867) im Steinkohlenteer die Stoffe Phenol und Anilin entdeckt hatte. William Henry Perkin – ein Schüler August Wilhelm von Hofmann – entdeckte im Jahr 1856 den ersten synthetischen Farbstoff – das Mauvein. Von Hofmann und Emanuel Verguin führten das Fuchsin in die Färberei ein. Johann Peter Grieß entdeckte die Diazofarbstoffe. Die organische Chemie gewann nun zunehmende industrielle und wirtschaftliche Bedeutung.
Von 1896 bis 1961 erschien das von Arnold F. Holleman, ab 1898 auch in deutscher Sprache (ab von 1930 von Friedrich Richter) herausgegebene Lehrbuch der organischen Chemie.
In den 1960er Jahren gelang die Herstellung von Valenzisomeren des Benzols durch aufwändige organische Synthesen. Bereits früher wurde mit dem 2-Norbornylkation ein nicht klassisches Carbokation gefunden, das fünf statt drei Bindungen zu anderen Atomen eingeht. 1973 wurde dann erstmals das pentagonal-pyramidale Hexamethylbenzol-Dikation mit sechsfach koordiniertem Kohlenstoff synthetisiert, dessen Struktur 2016 kristallographisch nachgewiesen werden konnte.[14]
Grundlagen der organischen Synthese in Schule und Studium
Die organische Chemie ist ein Teilbereich der Wissenschaft (Lehrbücher, Studium), deren Grundlagen im 19. Jahrhundert nur für eine kleine Schicht der Bevölkerung zugänglich war. Durch die Bildungsreformen im 20. Jahrhundert erhalten fast alle Schüler eine Wissensgrundlage in organischer Chemie. Der Chemieunterricht ermöglicht dem Schüler die Teilhabe an kultureller Bildung, fördert das Verständnis für die Einordnung und Zusammenhänge bei Fragen, die chemisch relevant sind. Politiker, Juristen, Betriebswirte, Informatiker, Maschinenbauer benötigen in unserer Kultur Basiskenntnisse in organischer Chemie, um Zusammenhänge besser einordnen zu können.
Umwandlungen von organischen Stoffen im Labor
In früherer Zeit untersuchten die organischen Chemiker beispielsweise den Einfluss von konzentrierten Säuren (Schwefelsäure, Salpetersäure, Salzsäure) auf organische Stoffe wie Ethanol, Baumwolle, Benzol.
Bei der Einwirkung von konzentrierter Schwefelsäure auf Ethanol entsteht ein neuer Stoff, der Diethylether, der ganz andere Eigenschaften als das Ethanol hatte und als Narkosemittel und als neues Lösungsmittel Anwendung gefunden hat. Bei der Einwirkung von Salpetersäure und Schwefelsäure auf Baumwolle entsteht die Schießbaumwolle, die als Explosivstoff, als Weichmacher und Lösemittel von Lacken, als Faser Verwendung fand.
Aus Benzol entsteht durch Einwirkung von konzentrierter Schwefelsäure und Salpetersäure das Nitrobenzol. Dieser Stoff ließ sich mit Reduktionsmitteln wie Eisenpulver und Salzsäure zu Anilin umwandeln. Anilin war das Ausgangsprodukt für viele neue Farbstoffe, die den Wohlstand unseres Gemeinwesens erhöhten.
Die Einwirkung von konzentrierter Schwefelsäure auf Baumwolle oder Holz ergibt Zuckermoleküle. Ähnlich wie in der anorganischen Chemie benutzten auch organische Chemiker bestimmte Nachweisreagenzien. Für organische Chemiker sind jedoch die funktionellen Gruppen im Molekül von großer Wichtigkeit. Mit Fehlingscher Lösung lassen sich Aldehydgruppen nachweisen. Funktionelle Gruppen können dazu genutzt werden, zwei organische Moleküle mit unterschiedlichen funktionellen Gruppen zu verknüpfen, so dass ein größeres Molekül entsteht. Durch Kenntnis der organischen Reaktionsmechanismen, der Wahl der Reagenzien und dem Einsatz von Schutzgruppen kann ein organischer Chemiker sehr komplexe organische Stoffe herstellen. Heutzutage können Peptide oder Proteine mit mehr als 100 Aminosäuren (mit einer molekularen Masse größer als 10.000) oder Kohlenhydrate sowie Pflanzeninhaltsstoffe (Terpene) synthetisiert werden. Kaum eine organische Reaktion verläuft mit 100 % Ausbeute, häufig ergeben sich auch unerwartete Nebenreaktionen, so dass komplexe Stoffe auf synthetischer Basis nur in geringer Menge (wenigen Milligramm bis mehreren Kilogramm) anfallen.
Viele organische Grundstoffe werden in der Industrie bei der Herstellung von Kunststoffen, Farbstoffen, Lösungsmitteln in sehr großen Mengen (1.000 bis 1.000.000 t) hergestellt. Spezialisierte Firmen verwenden die Industrieprodukte, um Feinchemikalien für Schule und Hochschule herzustellen. Der Organiker wünscht sich bei seinen Synthesen möglichst selektive Reagenzien, die nur eine bestimmte funktionelle Gruppe oxidieren, reduzieren oder mit einer anderen Gruppe verknüpfen.
Temperatureinfluss auf organische Reaktionen
Manchmal sind Stoffumsetzungen nur bei einer gesteigerten Temperatur möglich. Hohe Temperaturen werden in der organischen Chemie jedoch nur selten angewendet, da viele organische Stoffe durch eine erhöhte Temperatur zerstört werden. Die Reaktionstemperaturen in der organischen Chemie liegen daher meist zwischen Raumtemperatur und 150 °C. Die Wahl des Lösungsmittels und dessen Siedepunkt sind entscheidend für die Einstellung der Reaktionstemperatur. Eine Temperaturerhöhung um 10 °C verdoppelt in der Regel die Reaktionsgeschwindigkeit (RGT-Regel).
Beispiele für organische Reaktionen bei hoher Temperatur sind die Bildung von Aceton aus Calciumacetat und die Darstellung von 2,3-Dimethyl-butadien aus Pinakol.
Aus Calciumcarbonat und Essigsäure lässt sich das organische Salz Calciumacetat darstellen. Erhitzt man das Calciumacetat auf ca. 400 °C, so erhält man Aceton. Aceton und etwas Magnesium bilden den organischen Stoff Pinakol. Erhitzt man diesen Stoff bei 450 °C mit Aluminiumoxid, so bildet sich 2,3-Dimethyl-1,3-butadien. Stoffe mit Doppelbindungen lassen sich unter dem Einfluss einer Säure oder von Radikalbildnern polymerisieren, so dass ein Kunststoff mit ganz anderen Eigenschaften als das Monomer entsteht. Das polymerisierte 2,3-Dimethyl-1,3-butadien spielte eine wichtige Rolle als Ersatzstoff des früher sehr teuren Kautschuks. Fritz Hofmann konnte aus dem 2,3-Dimethyl-1,3-butadien den ersten synthetischen Methylkautschuk herstellen, der im Jahr 1913 in den Handel kam, als der Preis für natürlichen Kautschuk im Handel Höchstwerte erreichte.
Aufarbeitung nach einer Umsetzung
Nach einer chemischen Umsetzung muss der organische Chemiker zunächst die stark reaktiven, ätzenden, brennbaren Stoffe wie konzentrierte Schwefelsäure, Natrium, Natriumhydrid, Lithiumaluminiumhydrid mit geeigneten Stoffen in harmlose Verbindungen überführen. Darauf folgt eine Abtrennung der anorganischen Salze durch Ausschütteln im Scheidetrichter – unter Zusatz von weiterem organischen Lösungsmittel und einer wässrigen Lösung. Die organische Phase wird über wasserfreien Salzen wie Natriumsulfat getrocknet, dabei werden die letzten Reste von Wasser aus der organischen Phase entfernt. Das organische Lösungsmittel wird durch Destillation – häufig am Rotationsverdampfer – entfernt. Der eingedampfte Rückstand enthält das Reaktionsprodukt. Sehr selten kommt es vor, dass bei einer organischen Reaktion nur ein chemisches Produkt entsteht, vielfach entstehen Stoffmischungen aus unterschiedlichen organischen Stoffen. Durch eine fraktionierte Destillation im Vakuum oder durch eine Säulenchromatographie lassen sich die einzelnen Stoffe isolieren.
Chemische Strukturformel und Reaktionsmechanismus
Grundlage der Stoffkenntnis ist die chemische Strukturformel. Dies ist der Bauplan eines organischen Moleküls. Die Strukturformel eines Stoffes muss immer gedanklich aus Ergebnissen der Stoffanalyse abgeleitet werden. Die Stoffanalyse umfasst mindestens den korrekten Kohlenstoff-, Wasserstoff-, Sauerstoff- und Stickstoffgehalt eines Moleküls (Elementaranalyse), die Art der funktionellen Gruppen und die Bestimmung der molaren Masse.
Durch den kommerziellen Verkauf von Kernspinresonanzspektroskopen (NMR-Spektroskopie) und Massenspektrometern seit Anfang der sechziger Jahre an Hochschulen verkürzte sich die Zeit bis zur Strukturaufklärung von neuen komplizierten organischen Stoffen erheblich. Aus der Veränderung der Strukturformel vor und nach einer organischen Reaktion kann der Chemiker den Reaktionsmechanismus einer chemischen Reaktion ableiten. Alle organischen Moleküle, die einen ähnlichen Aufbau besitzen, können unter den gleichen Reaktionsbedingungen analoge Reaktionen eingehen. Der Chemiker kann durch die Kenntnis der Reaktionsmechanismen den Aufbau von neuen organischen Stoffen systematisch planen.
Eine sehr wichtige Reaktionsklasse bezieht sich auf den Ersatz eines Wasserstoffatoms im Molekül durch ein Halogen, eine Nitrogruppe, eine Sulfongruppe, man bezeichnet diese Reaktion als Substitution. Zu Beginn dieses Abschnittes wurden einige Beispiele aus dieser Reaktionsklasse genannt. Eine weitere wichtige Reaktionsklasse ist die Eliminierung. Die Abspaltung von Hydroxygruppen und Halogenen und der Ausbildung von Doppelbindungen im Molekül bezeichnet man als Eliminierung. Die Wasserabspaltung bei Pinakol zu 2,3-Dimethyl-1,3-butadien ist eine Eliminierung. Andere sehr wichtige Umsetzungen sind die Oxidation und die Reduktion von organischen Molekülen. Die Reduktion von Nitrobenzol zu Anilin durch Zink oder Eisenspäne in Anwesenheit einer Säure oder die Oxidation von Ethanol zu Acetaldehyd oder Essigsäure mittels Kaliumpermanganat sind Beispiele für diese Reaktionsklassen.
Bedeutung der organischen Chemie



In fast allen Gütern unseres täglichen Gebrauchs sind Stoffe der organischen Chemie vorhanden. Die Farbstoffe in Bildbänden, Zeitschriften, Verpackungsaufdrucken, die Kunststoffe im Großteil unserer Gebrauchsgüter in fast jedem Spielzeug, im Computergehäuse, in Rohrleitungen, Kabeln, Tragetaschen usw., die organischen Kunstfasern im großen Teil unserer Kleidung, die Lacke für Hausfassaden, Autos, den Wohnbereich, die Reinigungsmittel von einfachen Seifen bis komplexen Tensiden für Spezialanwendungen, die Arzneimittel, die Aroma- und Duftstoffe in Lebensmitteln und Blumen, die Lebensmittelkonservierungsstoffe, die Ionenaustauscher in Entsalzungsanlagen. Auch Holz und Baumwolle sind organische Stoffe, sie können durch ein reiches Vorkommen aus der Natur gewonnen werden. Die Mehrzahl der organischen Stoffe muss jedoch auf synthetischer Basis – hauptsächlich aus Erdöl – von der chemischen Industrie erzeugt werden. Bei einer weltweiten Verknappung von Erdöl könnte man gegenwärtig nur bedingt andere fossile Rohstoffe wie Kohle oder Erdgas nutzen, um die organischen Stoffe des täglichen Bedarfs herzustellen. Ein hoher Preis für Erdöl führt zu Anstrengungen, Substitutionsverfahren auf Basis von Kohle und Erdgas zu entwickeln. Die Verfahren werden jedoch weniger rentabel als auf Basis von Erdöl sein. Bei sehr hohen Preisen für Erdöl könnte es zu Verknappungen im Bereich der Konsumgüter kommen.
Organisch-chemische Industrie
Grundchemikalien
Basis für alle wichtigen synthetischen Stoffe sind die Grundchemikalien. Sie werden in großen Chemieanlagen aus Erdöl, Erdgas oder Kohle hergestellt.
Bis zum Zweiten Weltkrieg war die Kohle die Basis für die Grundchemikalien der organischen Chemie. Aus der Kohle konnte Benzol, Toluol, Xylol – Bausteine für organische Farbstoffe – gewonnen werden. Mit einem elektrischen Lichtbogen kann aus Kohle und Kalk das Kalziumcarbid (großtechnisch seit 1915) gewonnen werden. Kalziumcarbid lässt sich in Acetylen umwandeln und bildete damals nach Verfahren von Walter Reppe (Reppe Chemie) das Ausgangsprodukt für Acetaldehyd, Essigsäure, Aceton, Butylenglyckol, Butadien, Acrylsäure, Acrylnitril. Aus Kohle ließ sich auch Methanol (Synthese nach Pier) und Dieselöl (nach Bergius) gewinnen. Auch nach dem Zweiten Weltkrieg wurden viele Grundchemikalien noch aus Kohle hergestellt. Zwischen 1960 und 1970 wurden die Verfahren in den westlichen Industriestaaten durch modernere Verfahren auf Basis von Erdöl ersetzt.
Die Investitionskosten für derartige Anlagen sind beträchtlich, hauptsächlich sind in diesem Geschäftsbereich Firmen der Mineralölindustrie involviert. Früher wurden die chemischen Rohstoffe in die Industrieländer transportiert und dort chemisch zu Grundchemikalien umgewandelt. Noch in den achtziger Jahren waren die USA, Japan und die Bundesrepublik Deutschland die wichtigsten Chemieländer mit mehr als 50 % der Weltproduktion der organischen Grundstoffe. Im Zuge der weltweiten Verflechtungen und aus ökonomischen Gründen werden viele Anlagen in den Rohstoffländern (von Erdöl und Erdgas) errichtet.
Sehr wichtige Grundchemikalien sind Ethylen (19,5 Millionen Tonnen in EU-27, 2011), Propen (14,3 Mio. t, EU-27, 2011), 1,3-Butadien (2,8 Mio. t, EU-27, 2011), Methan, Benzol (7,4 Mio. t, EU-27, 2011), Toluol (1,5 Mio. t., EU-27, 2011), Xylol.[15][16] Aus diesen Grundchemikalien können weitere wichtige organische Grundstoffe hergestellt werden. Seit 2005 schwanken die Verkaufspreise in der EU für die organischen Grundstoffe erheblich, im Jahr 2010 stiegen die Verkaufspreise in der EU deutlich an.[17]
Aus Ethylen gewinnt die Industrie Polyethylen, Vinylacetat (nachfolgend Polyvinylacetat, Polyvinylalkohol, Polyvinylacetal), Acetaldehyd, Essigsäure, 1,2-Dichlorethan (nachfolgend Polyvinylchlorid), Ethylenoxid, Ethanol (nachfolgend Diethylether).
Aus Propylen gewinnen Unternehmen Polypropylen, Isopropanol (nachfolgend Aceton, Keten, Essigsäureanhydrid, Diketen, Essigsäureester, Acetylcellulose), Propylenoxid (nachfolgend Polyetherpolyole, Polyurethan), Allylchlorid (nachfolgend Epichlorhydrin, Glycerin, Allylalkohol), Acrylnitril (nachfolgend Polyacrylnitril, Acrylamid), Acrylsäure (nachfolgend Polyacrylate), Butanol.
Aus Methan gewinnt man Methanol (nachfolgend Formaldehyd und Ethylenglycol), Acetylen, Methylchlorid, Methylenchlorid, Chloroform (nachfolgend Tetrafluorethylen, Teflon), Tetrachlorkohlenstoff.
Aus Benzol wird Ethylbenzol (nachfolgend Styrol), Dihydroxybenzol (Resorcin, Hydrochinon und Brenzcatechin), Cumol (nachfolgend Phenol), Nitrobenzol (nachfolgend Anilin, Farbstoffe), Cyclohexan (nachfolgend Cyclohexanon, Adipinsäure, Nylon) synthetisiert. Aus Xylol kann Terephthalsäure, Phthalsäureanhydrid hergestellt werden.
Industrieprodukte, Spezialprodukte

Industrieprodukte sind überwiegend Mischungen von organischen Substanzen, die für eine anwendungstechnische Herstellung zubereitet worden sind.[18] Industrieprodukte werden in sehr großen Mengen (bis mehrere Mio. Tonnen) von der chemischen Industrie hergestellt, bei diesen Produkten sind die Rohstoffkosten sehr entscheidend für den Verkaufspreis.
Wichtige organische Industrieprodukte sind: Chemiefasern, Kunststoffe, Farbmittel, Kautschuk, Lösemittel, Tenside. Seit 2009 ist der Umsatz für Kunststoffe deutlich zurückgegangen.
Spezialprodukte sind organische Stoffe, die im Vergleich zu Industrieprodukten in deutlich geringerer Menge produziert werden. Der Verkaufspreis ist in geringerer Weise von Rohstoffkosten abhängig. Zu dieser Gruppe gehören beispielsweise Arzneimittel, Aromen und Duftstoffe, Enzyme, Lacke, Desinfektionsmittel, Diagnostika, Ionenaustauscherharze, Klebstoffe, Herbizide, Pflanzenschutzmittel, Waschmittel.[19]
Stoffgruppen der organischen Chemie
Es ergeben sich zwei Möglichkeiten für eine systematische Einteilung der einzelnen Substanzen der organischen Chemie in Stoffgruppen:
Einteilung nach funktioneller Gruppe
- Kohlenwasserstoffe ohne funktionelle Gruppe bilden die Ausgangsstoffe der organischen Chemie und die Grundlage ihrer Nomenklatur.
- Halogenkohlenwasserstoffe sind Kohlenwasserstoffe, bei denen mindestens ein Wasserstoffatom durch eines der Halogene Fluor, Chlor, Brom oder Iod ersetzt wurde.
- Sauerstoff- und Hydroxyverbindungen
- Stickstoffverbindungen
- Amine
- Amide
- Diazoniumsalze
- Nitroverbindungen, beispielsweise TNT
- Nitrile
- Schwefelverbindungen
- Phosphorverbindungen
- Phosphorsäureester
- Phosphine, beispielsweise Triphenylphosphin
- Metallorganische Verbindungen, beispielsweise Ferrocen
Einteilung nach Kohlenstoffgerüst

- aliphatische Kohlenwasserstoffe (Aliphaten)
- aromatische Kohlenwasserstoffe (Aromaten)
- einfache Aromaten
- kondensierte Aromaten
- Heterocyclen
- biochemische Verbindungen (Alkaloide, Aminosäuren, Kohlenhydrate, Proteine, Steroide, Terpene, Vitamine)
Reaktionen
Siehe Reaktionsmechanismus
Die Reaktionen in der organischen Chemie lassen sich größtenteils in die folgenden Grundtypen einordnen:
- Radikalische Substitution (SR)
- Nukleophile Substitution (SN):
- Nukleophile aliphatische Substitution
- Nukleophile aromatische Substitution
- Elektrophile Substitution (SE):
- Elektrophile aliphatische Substitution
- Elektrophile aromatische Substitution
- Eliminierung
- Nukleophile Addition (AN)
- Elektrophile Addition (AE)
- Radikalische Addition (AR)
- Pericyclische Reaktionen
- Umlagerung (sofern sie nicht zu oben genannten Reaktionstypen gehören)
- Oxidation sowie Reduktion
Darüber hinaus sind viele Reaktionen unter dem Namen ihres Entdeckers bekannt (siehe Liste von Namensreaktionen).
Eine Einteilung nach dem entstehenden Bindungstyp bzw. Baustein findet sich in der Liste von Reaktionen in der organischen Chemie.
Organisch-analytische Chemie
Die organische analytische Chemie beschäftigt sich mit der Untersuchung von organischen Stoffen. Dabei kann es darum gehen,
- Substanzen zu identifizieren (Nachweis);
- die Anwesenheit bzw. Abwesenheit von Verunreinigungen in Substanzen nachzuweisen (Bestimmung der Reinheit);
- die Mengenverhältnisse von Substanzen in Gemischen zu bestimmen (Gemisch);
- die Molekülstruktur von Substanzen aufzuklären (Strukturaufklärung).
Wichtige Methoden zum Nachweis und zur Reinheitsbestimmung (qualitative Analyse) sind klassische nasschemische Farb- und Niederschlagsreaktionen, biochemische Immunassay-Methoden und eine Vielfalt von chromatographischen Methoden.
Mengenverhältnisse in Gemischen (quantitative Analyse) festzustellen ist möglich durch nasschemische Titrationen mit unterschiedlicher Endpunktsanzeige, durch biochemische Immunassayverfahren und durch eine Vielzahl von chromatographischen Verfahren so wie durch spektroskopische Methoden, von denen viele auch zur Strukturaufklärung herangezogen werden, wie Infrarotspektroskopie (IR), Kernspinresonanzspektroskopie (NMR), Ramanspektroskopie, UV-Spektroskopie. Zur Strukturaufklärung werden neben charakteristischen chemischen Reaktionen weiterhin die Röntgenbeugungsanalyse und die Massenspektrometrie (MS) verwendet.
Literatur
- R. L. Shriner, R. C. Fuson, D. Y. Curtin, T. C. Morrill: The Systematic Identification of Organic Compounds – a laboratory manual 6. Edition, John Wiley & Sons New York/Chichester/Brisbane/Toronto 1980, ISBN 0-471-78874-0.
- Carl Schorlemmer: Ursprung und Entwicklung der organischen Chemie, Akademische Verlagsgesellschaft Geest & Portig, Leipzig, 1984.
- Hartmut Laatsch: Die Technik der organischen Trennungsanalyse, Georg Thieme Verlag Stuttgart/New York 1988, ISBN 3-13-722801-8.
- Heinz A. Staab: Hundert Jahre organische Strukturchemie. Angewandte Chemie 70(2), S. 37–41 (1958), doi:10.1002/ange.19580700202.
- K.P.C. Vollhardt und N.E. Schore: Organische Chemie. 4. Auflage, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8.
- Joachim Buddrus: Grundlagen der Organischen Chemie, Walter de Gruyter, Berlin – New York, 3. Auflage 2003, ISBN 978-3-11-014683-7.
- H. Hart, L.E. Craine, D. J. Hart, C. M. Hadad, N. Kindler: Organische Chemie. 3. Aufl. Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8.
- dtv-atlas Chemie (Hans Breuer): Band 2: Organische Chemie und Kunststoffe, 9. Auflage 2006, Deutscher Taschenbuch Verlag, ISBN 3-423-03218-9.
Weblinks
- Die organische Chemie verständlich für Schüler und Studenten
- Portal Organische Chemie
- Sammlung von frei zugänglichen online-Lehrgängen zur Organischen Chemie
- Organicworldwide (englisch)
- Mitschnitte von Vorlesungen der Universität Tübingen, Experimentalchemie II, Organische Chemie, Sommersemester 2002, 52 Stunden
Einzelnachweise
- ↑ Furni Novi Philosophici I, Amsterdam 1648–1650, 66.
- ↑ Furni Novi Philosophici I, Amsterdam 1648–1650, 77.
- ↑ Furni Novi Philosophici I, Amsterdam 1648–1650, 99.
- ↑ Furni Novi Philosophici II, Amsterdam 1648–1650, 181.
- ↑ Furni Novi Philosophici II, Amsterdam 1648–1650, 71.
- ↑ Opera Chymica I, 50.
- ↑ Pogg. Ann. 31 (1831), 1–43.
- ↑ Otto Westphal, Theodor Wieland, Heinrich Huebschmann: Lebensregler. Von Hormonen, Vitaminen, Fermenten und anderen Wirkstoffen. Societäts-Verlag, Frankfurt am Main 1941 (= Frankfurter Bücher. Forschung und Leben. Band 1), S. 38.
- ↑ Gilberts Ann. 40, 247.
- ↑ Ann. Chim.Phys. 24, 264.
- ↑ Pogg. Ann. 12, 253 (1828).
- ↑ Hermann Kolbe, Ueber den natürlichen Zusammenhang der organischen mit den unorganischen Verbindungen, die wissenschaftliche Grundlage zu einer naturgemässen Classification der organischen chemischen Körper Ann. Chem. 113, 1860, 293.
- ↑ Friedrich August Kekulé: Ueber die gepaarten Verbindungen und die Theorie der mehratomigen Radikale. In: Liebigs Annalen der Chemie 104/2, 1857, S. 129–256, doi:10.1002/jlac.18571040202
- ↑ Moritz Malischewski, K. Seppelt: Die Molekülstruktur des pentagonal-pyramidalen Hexamethylbenzol-Dikations im Kristall. In: Angewandte Chemie, 129, 2017, S. 374, doi:10.1002/ange.201608795.
- ↑ Hans-Bernd Amecke: Chemiewirtschaft im Überblick, S. 74–75, VCH Verlagsgesellschaft mbH, Weinheim 1987, ISBN 3-527-26540-6.
- ↑ Europäische Kommission: Eurostat.
- ↑ VCI: Broschüren & Faltblätter.
- ↑ Hans-Bernd Amecke: Chemiewirtschaft im Überblick, S. 74–85, VCH Verlagsgesellschaft mbH, Weinheim 1987, ISBN 3-527-26540-6.
- ↑ Hans-Bernd Amecke: Chemiewirtschaft im Überblick, S. 109–129, VCH Verlagsgesellschaft mbH, Weinheim 1987, ISBN 3-527-26540-6.
Auf dieser Seite verwendete Medien
Struktur von Nikotin
Autor/Urheber: Eva K. / Eva K., Lizenz: CC BY-SA 2.5
Aus meinem Garten: Rosa 'Ave Maria', Züchter Kordes, 1981
Jöns Jakob Berzelius, lithography portrait from 1836 made by P.H. van den Heuvell, litho by F.J. Backer
Autor/Urheber: Tommy Wong, Lizenz: CC BY 2.0
A Chinese girl taking a break in a swimming pool, grabbing on to a rainbow-coloured foam flotation device, probably polyethylene foam.
Struktur von Acetylsalicylsäure
Harnstoff-Synthese_Wöhler
Cyclohexan Sessel-Konformation










