Gloeotrichia
| Gloeotrichia | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Gloeotrichia echinulata, gefärbt mit SYTOX | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Gloeotrichia | ||||||||||||
| J. Agardh ex Bornet & Flahault, 1886[1][2] |
Gloeotrichia (ursprünglich Glœotrichia geschrieben) ist eine Gattung (mit ca. 2 mm) großer Cyanobakterien in der Ordnung Nostocales, die Kolonien bilden.[3][2] Gloeotrichia kommen kosmopolitisch in Seen auf der ganzen Welt vor und spielen eine dabei wichtige Rolle im Stickstoff- und Phosphorkreislauf.[3][4] Gloeotrichia-Arten tragen nachweislich zur Eutrophierung von Seen bei und produzieren tödliche Toxine, was große Probleme bereiten kann.[5][6]
Etymologie
Der Name Gloeotrichia leitet sich von ihrem Aussehen als fadenförmiger Körper mit Schleimmatrix ab:[7][8]
- neulateinisch gloea, deutsch ‚Gummi‘, englisch gum bzw.
altgriechisch γλοιόςgloios, deutsch ‚eine klebrige Substanz, Gummi‘; gr. γλοίαgloia, deutsch ‚Leim‘, englisch glue - gr. τριχιάtrichia, deutsch ‚Haar‘
Morphologie
Die primäre Morphologie (Biologie) der Spezies (Arten) von Gloeotrichia ist trichomös (fadenförmig ohne Hüllen), die sekundäre ist kolonial, d. h. die Gloeotrichia-Arten bilden kugelförmige Kolonien aus strahlenförmig angeordneten geraden Trichomen. Jedes Trichom hat eine Akinete[9] als Basalzelle in der Nähe des Zentrums der Kolonie. Wenn Akineten vorhanden sind, liegen sie neben der Heterozyste. Die Trichome sind am apikalen Bereich (an der Spitze) verjüngt und die schleimige Hülle ist dort nicht stark ausgebildet. Die Heterozysten sind in der Regel kugelförmig. Die vegetativen (nicht der geschlechtlichen Vermehrung dienenden) Zellen sind kürzer und tonnenförmig. Die Trichome sind in der Basalregion fest verwachsen. Geschlechtsorgane sind in diesen prokaryotischen Kolonien nicht vorhanden.[10]
Arten
Für die folgende Liste der Arten in der Gattung Gloeotrichia wurden als Quellen benutzt (Stand 8. Oktober 2021, Unterarten und Stämme sind nur teilweise angegeben):
Der taxonomische Pfad für diese Gattung ist lt. NCBI:
Bacteria; Terrabacteria-Gruppe; Cyanobacteria/Melainabacteria-Gruppe; Cyanobacteria; Nostocales; Gloeotrichiaceae
Gattung Gloeotrichia J. Agardh exBornet & Flahault, 1886 (veraltete Schreibweise Glœotrichia, Fehlschreibungen lt. LPSN Glaeotriclzia, Glceotrichia, Gloeolrichia, Gloeothrichia, Gloeothrirhia, Gloiotricliia, Gloitrichia)
- Spezies G. aethiopica West & G.S.West, 1897(A,W)
- Spezies G. andrenszkyana Claus, 1957(A,W)
- Spezies G. aurantiaca Komarék et al., 2013(A,W)
- Spezies G. dimorpha Y.-Y.Li, 1994(A,W)
- Spezies G. echinulata P.G.Richter, 1894(A,L,N,W)
- Stamm G. e. CCAP 1432/1(N)
- Stamm G. e. FACHB-419(N)
- Stamm G. e. I4(N)
- Stamm G. e. PYH14(N)
- Stamm G. e. PYH6(N)
- Stamm G. e. URA3(N)
- Spezies G. flagelliformis N.L.Gardner, 1927(A,W)
- Spezies G. ghosei R.N.Singh, 1939(A,L,N,W)
- Stamm G. g. UTEX LB 1920(N)
- Stamm G. g. UTEX LB 1921(N)
- Spezies G. indica Schmidle(A)
- Spezies G. intermedia (Lemmermann) Geitler, 1925(A,W)
- Spezies G. juignetii Frémy, 1945(A,W) (Verschreiber/Alias: G. jugnetii)
- Spezies G. kamtschatica (Elenkin) Poljansij, 1938(A,W)
- Spezies G. letestui Frémy, 1924(A,W)
- Spezies G. longiarticulata G.S.West, 1907(A,W)
- Spezies G. longicauda Schmidle, 1901(N,W)
- Stamm G. l. SAG 32.84(N)
- Spezies G. murgabica Kogan & Jazkulieva, 1972(A,W)
- Spezies G. natans Rabenhorst exBornet & Flahault, 1886(A,W)
- Spezies G. pilgeri Schmidle, 1901(A,W)
- Spezies G. pisum Thuret exBornet & Flahault, 1886(A,L,N,W) (Typus, syn. G. incrustata Wolle, 1869(A)
- Stamm G. p. SL6-1-1(N)
- Subspezies G. p. var. lens (Meneghini)(A) (syn. G. lens,(Meneghini) Endlicher, 1843(A))
- Subspezies G. p. var. solida (Richter) Hansgirg(A) (syn. G. solida,Richter, 1887(A))
- Spezies G. punctulata Thuret exBornet & Flahault, 1886(A,W) – marin(W)
- Spezies G. rabenhorstii Bornet exBornet & Flahault, 1886(A,W)
- Spezies G. raciborskii Woloszynska, 1912(A,W)
- Subspezies G. r. var. lilienfeldiana (Woloszynska) Geitler(A) (syn. G. lilienfeldianai Woloszynska, 1912(A,W))
- Spezies G. salina Rabenhorst exBornet & Flahault, 1886(A,W) – marin(W)
- Spezies G. seriata C.-C.Jao, 1939(A,W)
- Spezies G. spiroides Kondratyeva [Kondrat’eva], 1954(A,W)
- Spezies G. tuzsonii Palik, 1941(A,W)
- Spezies „G. angulosa“ (Roth) J.Agardh(A)
- Spezies „G. kurziana“ Zeller(A)
- Spezies „Gloeotrichia sp. 4701“(N)
- Spezies „Gloeotrichia sp. PMC236.04“(N)
Unbestätigte/unsichere Arten sind in Anführungszeichen gelistet.
Alle bestätigten Arten sind Süß- (der zumindest Brackwasser-)arten, außer den beiden Salzwasserarten G. punctulata und G. salina (WoRMS).
Ähnliche Gattungen
Die Cyanobakteriengattung Rivularia (ebenfalls Mitglied der Ordnung Nostocales) bildet morphologisch ähnliche Kolonien, wenn sie mit dem Substrat (Material, auf oder in dem ein Organismus lebt) verbunden sind. Diese weisen dann ebenfalls strahlenförmige, sich verjüngende Fäden mit basalen Heterocysten auf.[16]
Habitat
Die Vertreter der Gattung Gloeotrichia besiedel typischerweise Süßwasser-Gebiete, obwohl es auch angepasste Formen für Brack- und Salzwasser gibt.[11] In Nordamerika beobachtet man im Spätsommer und Herbst in vielen abgelegenen oligotrophen Seen ein plötzliches und unerwartetes Auftreten von Gloeotrichia, auch in an sich unberührten Seen in den ungestörten Wassereinzugsgebieten der borealen Wälder. Im Jahr 2012 wurde Gloeotrichia auch in 26 von 27 als „nährstoffarmen“ eingestuften Seen in Neuengland (USA) gefunden (Carey et al. 2012).[17]
Wahrscheinlich entwickeln sich die Kolonien im Bodenwasser, wo die Mineralisierung des Sediments einen Teil des Phosphats freisetzt. Sie passen dann ihren Auftrieb mit der Verdrängung von Bakterioplasma (Bakterien-Zytoplasma) durch langgestreckte Gasbläschen an und steigen an die Oberfläche, wo sie durch windgetriebene Wasserströmungen horizontal verteilt werden können. Da die benthischen Kolonien relativ synchron aufsteige bilden sich aufgrund dieser „Rekrutierung“ aus den Sedimenten dann im Mittel- bis Spätsommer Blüten. Dies konnte 2014 in umgekehrten Trichterfallen (englisch inverted funnel traps) mit bis zu 104 Kolonien pro Quadratmeter und Tag im Lake Sunapee (43,3741° N, 72,124° W, New Hampshire, USA),[18][19] gemessen werden (Carey et al. 2014).[20]
Beweise dafür, dass Gloeotrichia meroplanktonisch ist und einen Teil (oder sogar den größten Teil) des Jahres in den Sedimenten verbringt, stammen aus Wachstumsexperimenten in Mesokosmen[Anm. 1] am Erkensee (59,8459° N, 18,5718° O, en. Lake Erken, Stockholms Län, Schweden).[21][22] Während die Kolonien im Freiwasser (pelagisch) im Juli 2000–2001 zunahmen, nahmen die Kolonien in den Mesokosmen mit 41 und 300 l (Litern) Volumen ab, selbst bei Zugabe von verschiedenen Nährstoffkombinationen; eine Ausnahme gab es lediglich bei Zugabe von N, P und Fe. Die Schlussfolgerung ist, dass phosphatreiche Sedimente das Wachstum der Kolonien ermöglichen und dass der zunehmende Auftrieb der Kolonien im Juli sie in die pelagische Zone bringt (Karlsson-Elfgren et al., 2005).[23]
Gloeotrichia wird auch aus einigen abgelegenen nährstoffreichen Seen inmitten von Reisfeldern in Westbengalen, Indien, gemeldet (Halder & Sinha, 2013).[24] Weitere Untersuchungen wären hier hilfreich.
Phosphorzyklus
Seen haben grundsätzlich mehrere Quellen für Phosphor (P), aber eine große Quelle befindet sich in den Bodensedimenten oder im Benthos. Der Phosphor im Benthos ist im Allgemeinen in organischem Material oder an Metalle wie Eisen gebunden. Die sommerliche Schichtung in der Wassersäule verhindert jedoch, dass der Phosphor in das Epilimnion oder die oberen Schichten gelangt.[25]
Die Gattung Gloeotrichia wird mit dem Phosphorkreislauf in Seen in Verbindung gebracht, da sie bei ihrer Wanderung Phosphor aus dem Benthos in das Epilimnion transportiert.[25] Über den Winter bildet Gloeotrichia Ruhezellen (Akineten),[9] die keimen und Kolonien bilden, sobald die Temperaturen steigen.[26] Während diese Zellen wachsen, nehmen sie Nährstoffe wie Phosphor auf. Dabei nehmen sie im Allgemeinen mehr Nährstoffe auf, als sie unmittelbar benötigen, und speichern den Überschuss sie für eine spätere Verwendung, etwa wenn sie in das nährstoffarme Epilimnion abwandern.[26][27][4] Der minimale zelluläre Phosphorbedarf von Gloeotrichia liegt bei etwa 2,3 µg (Mikrogramm) Phosphor (P) pro mg (Milligramm) Kohlenstoff (C). Die tatsächliche Aufnahme liegt dann bei 25 bis 500 µg (P) pro Liter und Tag, viel im Vergleich zu anderen Cyanobakterien und Algen, die normalerweise 1 bis 100 µg (P) pro Liter und Tag aufnehmen.[28][29][30] Sobald Gloeotrichia genug Phosphor gespeichert hat, um die Koloniebildung und das Wachstum aufrechtzuerhalten, beginnen die Organismen, mit Gas gefüllte Vakuolen zu bilden, um ihren Auftrieb zu erhöhen und wandern damit hoch ins Epilimnion.[27] Dort ermöglichen die zusätzlichen Nährstoffe ein weiteres Wachstum der Kolonien.[28]
Diese Kolonien bilden sich so in der Regel von Ende Juni bis Juli.[26] Mit der Wanderung von Gloeotrichia steigt der prozentuale Anteil von Phosphor im Epilimnion, der auf Gloeotrichia zurückzuführen ist, von 1 % auf 53 %,[4] wobei die Wanderung von Gloeotrichia einen (vertikalen) Phosphor-Fluss von 2,25 mg pro Quadratmeter und Tag verursacht.[27] Diese erhöhte Phosphormenge ermöglicht es Gloeotrichia, andere Cynobakterien- und Algenarten in einem nährstoffarmen Epilimnion zu überflügeln.[27]
Stickstofffixierung
Neben ihrer Rolle im Phosphorkreislauf spielen Gloeotrichia-Arten auch eine wichtige Rolle im Stickstoffkreislauf der Seen. Wie viele andere Cyanobakterien besitzen sie das Enzym Nitrogenase, das es ihnen ermöglicht, Stickstoff aus seiner biologisch nicht verfügbaren Form (gelöstes Distickstoffgas N2) in biologisch verfügbares Ammoniak (NH3) umzuwandeln.[31] Durch diese Stickstofffixierung kann Gloeotrichia andere Phytoplanktonarten verdrängen und in stickstoffarmer Umgebung gedeihen. Die N-Fixierung durch Cyanobakterien wirkt sich auch auf die Gesamtstruktur der Phytoplanktongemeinschaft aus, indem sie den Pool an biologisch verfügbarem Stickstoff in einem See vergrößert.[5] Dieser Anstieg fördert häufig die Phytoplanktonproduktion und begünstigt indirekt auch Organismen, die in nährstoffreichen Umgebungen besser gedeihen.[5][32]
Toxine
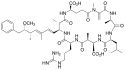
Obwohl die Forschung über die Produktion von Toxinen durch bestimmte Gloeotrichia-Arten noch ziemlich überschaubar ist, ist sicher, dass einige Arten potenziell schädlich sind. Im Lake Sunapee[19][18] wurde festgestellt, dass Gloeotrichia echinulata Microcystin LR (MC-LR, en. Microcystin-LR)[33] produziert, was eine Gefahr für die Gesundheit von Menschen und aquatischen Ökosystemen darstellen könnte.[6] Microcystine sind eine Gruppe potenter Heptapeptid-Hepatotoxine (aus 7 Aminosäuren aufgebaute Lebertoxine), die mehr als 85 bekannte Varianten umfasst und von verschiedenen Arten aquatischer Cyanobakterien produziert wird,.[34] MC-LR ist darunter das toxischste.[35][36] Gloeotrichia echinulata kommt in einer Vielzahl von Ökosystemen vor; potenziell gefährliche Blüten bilden diese Spezies aber vorzugsweise in Seen mit eutrophem und schlechtem ökologischen Zustand.[37]
Anmerkungen
- ↑ Ein Mesokosmos (englisch mesocosm, aus meso- mittel und -kosmos Welt) ist ein Experimentiersystem im Freien, das die natürliche Umwelt unter kontrollierten Bedingungen untersucht.
Einzelnachweise
- ↑ J. Komárek, J. Kaštovský, J. Mareš, J. R. Johansen: Taxonomic classification of cyanoprokaryotes (cyanobacterial genera) 2014, using a polyphasic approach. In: Preslia. 86, 2014, S. 295–335.
- ↑ a b E. Bornet, C. Flahault: Revision des Nostocacées hétérocystées contenues dans les principaux herbiers de France (deuxième fragment). In: Annales des Sciences Naturelles, Botanique. Septième Série 4, 1886/1887, S. 343–373 (französisch, img.algaebase.org PDF).
- ↑ a b Cayelan C. Carey, Kathleen C. Weathers, Kathryn L. Cottingham: Gloeotrichia echinulata blooms in an oligotrophic lake: helpful insights from eutrophic lakes. In: Journal of Plankton Research. Band 30, Nr. 8, 2008, ISSN 0142-7873, S. 893–904, doi:10.1093/plankt/fbn055 (englisch).
- ↑ a b c Kurt Pettersson, Eva Herlitz, Vera Istvánovics: The role of Gloeotrichia echinulata in the transfer of phosphorus from sediments to water in Lake Erken. Hrsg.: P. C. M. Boers, Th. E. Cappenberg, W. van Raaphorst. Springer Netherlands, Dordrecht 1993, ISBN 978-94-011-1598-8, S. 123–129, doi:10.1007/978-94-011-1598-8_15 (englisch).
- ↑ a b c Kathryn L. Cottingham, Holly A. Ewing, Meredith L. Greer, Cayelan C. Carey, Kathleen C. Weathers: Cyanobacteria as biological drivers of lake nitrogen and phosphorus cycling. In: Ecosphere. Band 6, Nr. 1, 2015, ISSN 2150-8925, S. art1, doi:10.1890/ES14-00174.1 (englisch).
- ↑ a b Cayelan C. Carey, Holly A. Ewing, Kathryn L. Cottingham, Kathleen C. Weathers, R. Quinn Thomas, James F. Haney: Occurrence and toxicity of the cyanobacterium Gloeotrichia echinulata in low-nutrient lakes in the northeastern United States. In: Aquatic Ecology. 46, Nr. 4, 1. Dezember 2012, ISSN 1573-5125, S. 395–409. doi:10.1007/s10452-012-9409-9.
- ↑ Glia meaning, aourdictionary.com
- ↑ O. P. Sharma: Textbook Of Algae, Tata McGraw-Hill Education, 1. Januar 1986, ISBN 978-0-07-451928-8. Hier: S. 115
- ↑ a b c Akineten, Lexikon der Biologie, spektrum.de
- ↑ a b AlgaeBase: Gloeotrichia J.Agardh ex Bornet & Flahault, 1886
- ↑ a b WoRMS: Gloeotrichia J.Agardh ex Bornet & Flahault, 1886
- ↑ LPSN: Genus Gloeotrichia Agardh ex Bornet and Flahault 1886
- ↑ NCBI: Gloeotrichia (Agardh 1824) ex Bornet and Flahault 1886 (genus); graphisch: Gloeotrichia, auf: Lifemap, NCBI Version.
- ↑ Iris Pereira, M. Moya, G. Reyes, V. Kramm: a Survey of Heterocystous Nitrogen-fixing Cyanobacteria in Chilean Rice Fields. In: Gayana. Botánica. Band 62, Nr. 1, 2005, ISSN 0717-6643, S. 26–32, doi:10.4067/S0717-66432005000100005.
- ↑ M. C. Cooke: Fresh-Water Algae. Band II: Plates (Tafeln). Williams & Norgate, London 1882–1884 (Textarchiv – Internet Archive)
- ↑ AlgaeBase: Rivularia C.Agardh ex Bornet & Flahault, 1886, nom. cons.
- ↑ Cayelan C. Carey, Holly A. Ewing, Kathryn L. Cottingham, Kathleen C. Weathers, R. Quinn Thomas, James F. Haney: Occurrence and toxicity of the cyanobacterium Gloeotrichia echinulata in low-nutrient lakes in the northeastern United States. In: Aquatic Ecology. Band 46, Nr. 4, 31. Juli 2012, ISSN 1573-5125, S. 395–409, doi:10.1007/s10452-012-9409-9 (carey.biol.vt.edu [PDF]).
- ↑ a b Lake Sunapee, New Hampshire Lakes Region
- ↑ a b Sunapee Lake, auf: Mapcarta
- ↑ Cayelan C. Carey, Kathleen C. Weathers, Holly A. Ewing, Meredith L. Greer, Kathryn L. Cottingham: Spatial and temporal variability in recruitment of the cyanobacterium Gloeotrichia echinulata in an oligotrophic lake. In: Freshwater Science. Band 33, Nr. 2, 2014, ISSN 2161-9549, S. 577–592, doi:10.1086/675734, JSTOR:10.1086/675734.
- ↑ Lake Erken, auf: BlooWater (bloowater.eu)
- ↑ Erken, auf: Mapcarta
- ↑ Irene Karlsson-Elfgren, Per Hyenstrand, Emil Riydin: Pelagic growth and colony division of Gloeotrichia echinulata in Lake Erken, in: Journal of Plankton Research, Band 27, Nr. 2, 1. Februar 2005, S. 145–151, doi:10.1093/plankt/fbh165. Mit Korrektur vom März 2005, doi:10.1093/plankt/fbi002.
- ↑ Nilu Halder, Sankar Narayan Sinha: Diversity of the genera Gloeotrichia Agardh and Rivularia (Roth.) Agardh from Hooghly district of West Bengal, India, in: Indian Journal of Fundamental and Applied Life Sciences, Band 3, Januar 2013, S. 29–35.
- ↑ a b FAQ About Gloeotrichia (PDF) In: Belgrade Lakes Association.
- ↑ a b c Irene Karlsson Elfgren: Studies on the Life Cycles of Akinete Forming Cyanobacteria. (PDF) In: Comprehensive Summaries of Uppsala Dissertations from the Faculty of Science and Technology. 2003.
- ↑ a b c d Whitney King, Douglas P. Laliberte: Analysis of the effects of Gloeotrichia echinulata on Great Pond and Long Pond, Maine. In: www.colby.edu. 12. Mai 2006. Abgerufen am 8. Oktober 2021.
- ↑ a b Vera Istvánovics, Kurt Pettersson, Maria A. Rodrigo, Donald Pierson, Judit Padisák, William Colom: Gloeotrichia echinulata, a colonial cyanobacterium with a unique phosphorus uptake and life strategy. In: Journal of Plankton Research. 15, Nr. 5, 1. Januar 1993, ISSN 0142-7873, S. 531–552. doi:10.1093/plankt/15.5.531. ResearchGate (freier Volltext).
- ↑ Ralph E. Smith, Jaap Kalff: Size-dependent phosphorus uptake kinetics and cell quota in phytoplankton, in: Journal of Phycology, Band 18, Nr. 2, November 2004, S. 275–284, doi:10.1111/j.1529-8817.1982.tb03184.x
- ↑ D. K. Button: Kinetics of Nutrient-Limited Transport and Microbial Growth, in: Microbiological Reviews, Band 49, Nr. 3, September 1985, S. 270–297, doi:10.1128/mr.49.3.270-297.1985, PMC 373036 (freier Volltext), PMID 3930934
- ↑ P. Fay: Oxygen relations of nitrogen fixation in cyanobacteria. In: Microbiology and Molecular Biology Reviews. 56, Nr. 2, 1. Juni 1992, ISSN 1092-2172, S. 340–373. PMID 1620069.
- ↑ Cayelan C. Carey, Bryan L. Brown, Kathryn L. Cottingham: The cyanobacterium Gloeotrichia echinulata increases the stability and network complexity of phytoplankton communities. In: Ecosphere. Band 8, Nr. 7, 2017, ISSN 2150-8925, S. e01830, doi:10.1002/ecs2.1830 (englisch).
- ↑ PubChem: Microcystin-LR, syn. Cyanoginosin LR (CAS-Nr.: 101043-37-2)
- ↑ Kaarina Sivonen: Encyclopedia of Microbiology: Cyanobacterial Toxins. Elsevier Scientific Publ. Co, Amsterdam 2009, ISBN 978-0-12-373939-1, S. 290–307.
- ↑ Susana R. Pereira, Vítor M. Vasconcelos, Agostinho Antunes: Computational study of the covalent bonding of microcystins to cysteine residues - a reaction involved in the inhibition of the PPP family of protein phosphatases. In: FEBS Journal 16. Dezember 2011, doi:10.1111/j.1742-4658.2011.08454.x
- ↑ Alexandre Campos, Vitor Vasconcelos: Molecular Mechanisms of Microcystin Toxicity in Animal Cells. In: International Journal of Molecular Sciences. Band 11, Nr. 1, 2010, ISSN 1422-0067, S. 268–287, doi:10.3390/ijms11010268, PMID 20162015, PMC 2821003 (freier Volltext).
- ↑ A. Napiorkowska-Krzebietke, A. Hutorowicz: The physicochemical background for the development of potentially harmful cyanobacterium Gloeotrichia echinulata J. S. Smith ex Richt. In: Journal of Elementology. 20, Nr. 2, 2015, ISSN 1644-2296. doi:10.5601/jelem.2014.19.4.756.
Auf dieser Seite verwendete Medien
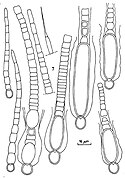
Autor/Urheber: Cooke, M. C. (Mordecai Cubitt), b. 1825, Lizenz: No restrictions
Title: British fresh-water algae, exclusive of Desmidieae and Diatomaceae
Identifier: britishfreshwate00platescook (find matches)
Year: 1882-1884 (1880s)
Authors: Cooke, M. C. (Mordecai Cubitt), b. 1825
Subjects: Algae -- Great Britain
Publisher: London, New York, Williams and Norgate
Contributing Library: MBLWHOI Library
Digitizing Sponsor: MBLWHOI Library
View Book Page: Book Viewer
About This Book: Catalog Entry
View All Images: All Images From Book
Click here to view book online to see this illustration in context in a browseable online version of this book.
Text Appearing Before Image:
CALOTRICHÆ. PL. 116.
Text Appearing After Image:
Note About Images
Chemical structure of microcystin LR.
Harmful Water Organisms — Here's a photo taken of gloeotrichia echinulata under an epifluorescent microscope which emits ultraviolet light. Using ultraviolet light, the filaments glow red from chlorophyll, while other pigments give various hues of purple, which may be a hint about the health of the cells.
There may be organisms in lakes, reservoirs, rivers and streams, that produce natural toxins. When a harmful algal bloom is present with these toxins, there is a risk from drinking the water or consuming fish and shellfish. This organism is just one example. The Native American and Alaska Native communities that are dependent on subsistence fishing have an increased risk of exposure to these cyanotoxins. It is important to recognize the presence of an algal bloom in a waterbody and to distinguish a potentially toxic harmful algal bloom from a non-toxic bloom.
Scientists at USGS created a guide which provides field images that show cyanobacteria blooms, some of which can be toxin producers, as well as other non-toxic algae blooms and floating plants that might be confused with algae. The guide also provides microscopic images of the common cyanobacteria that are known to produce toxins, as well as images of algae that form blooms but do not produce toxins. You can see the full report at on.doi.gov/HarmfulAlgalBlooms.Cyanobacterium Gloeotrichia echinulata stained with Sytox, a green cyanine nucleic acid dye. Radiating filaments and basal heterocysts visible. Specimen from Oregon, USA.
Autor/Urheber: Øjvind Moestrup at WoRMS (World of Marine Species), Lizenz: CC BY-SA 4.0
Gloeotrichia echinulata. Original Source:; Cronberg G & Annadotter H (2006) Manual on aquatic cyanobacteria. A photo guide and synopsis of their toxicology. Published by ISSHA and IOC of UNESCO, Copenhagen. Author: Øjvind Moestrup
Autor/Urheber: Panek, Lizenz: CC BY-SA 3.0 pl
An akinete of unidentified Gloeotrichia
Autor/Urheber: Iris Pereira, M. Moya, G. Reyes, V. Kramm, Lizenz: CC BY-SA 4.0
Gloeotrichia natans Rabenh. ex Bornet & Flahault