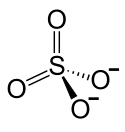
Eisen(III)-sulfat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
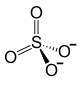 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Eisen(III)-sulfat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | Fe2(SO4)3 | |||||||||||||||
| Kurzbeschreibung | farb- und geruchloses, hygroskopisches, feuchtigkeits- und lichtempfindliches Pulver[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 399,88 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eisen(III)-sulfat ist eine chemische Verbindung aus der Gruppe der Sulfate.
Vorkommen
Eisen(III)-sulfat fällt als Abfallprodukt der chemischen Industrie an.
In der Natur ist Eisen(III)-sulfat in Form verschiedener kristallwasserhaltiger (hydratisierter) Minerale bekannt, die typischerweise durch die Verwitterung von Pyrit entstehen. Reine Fe2(SO4)3-Verbindungen sind dabei Kornelit (Heptahydrat, Fe2(SO4)3·7H2O), Lausenit (Pentahydrat Fe2(SO4)3·5H2O), Paracoquimbit (Nonahydrat, vereinfacht Fe2(SO4)3·9H2O) und Quenstedtit (Hendekahydrat, Fe2(SO4)3·11H2O).
Hinzu kommen weitere Minerale, bei denen ein bis zwei Sulfatmoleküle durch komplexfremde Anionen ersetzt sind, namentlich Amarantit (Fe2O(SO4)2·7H2O), Butlerit (Fe(SO4)(OH)·2H2O), Ferricopiapit (vereinfacht Fe5(SO4)6(OH)2·20H2O), Fibroferrit (Fe(SO4)(OH)·5H2O), Hohmannit (Fe2O(SO4)2·8H2O), Metahohmannit (Fe2O(SO4)2·4H2O), Parabutlerit (Fe(SO4)(OH)·2H2O), Schwertmannit (Fe16O16(OH)9.6(SO4)3.2·10H2O) und Volaschioit (Fe4(SO4)O2(OH)6·2H2O).[5]
Im weiteren Sinne Eisensulfate, bei denen komplexfremde Kationen ein bis zwei Sulfatkomplexe ersetzen, sind unter anderem Aluminocoquimbit (Al2Fe2(SO4)6(H2O)12·6H2O), Amarillit (NaFe(SO4)2·6H2O) Coquimbit (AlFe3(SO4)6(H2O)12⋅6H2O), Hydroniumjarosit ((H3O)Fe3(SO4)2(OH)6) und Rhomboklas ((H5O2)Fe(SO4)2·2H2O).[6]
Gewinnung und Darstellung
Eisen(II)-sulfat-Monohydrat FeSO4·H2O zerfällt bei starkem Erhitzen ab etwa 400 °C zu basischem Eisen(III)-sulfat und Schwefeldioxid. Es entsteht auch bei der Zersetzung von Eisen(II)-sulfat-Heptahydrat FeSO4·7 H2O an Luft.[7]
Großtechnisch wird Eisen(III)-sulfat durch Zugabe von Schwefelsäure und einem Oxidationsmittel (z. B. Salpetersäure oder Wasserstoffperoxid) zu einer heißen Eisen(II)-sulfatlösung gewonnen.[8]
Es entsteht auch als Zwischenprodukt beim Copperas-Prozess.[9]
Eigenschaften
In Wasser löst sich Eisen(III)-sulfat unter starker Hydrolyse mit gelbbrauner Farbe (Bildung u. a. von [Fe(OH)(H2O)5]2+). Beim Kochen wässriger Lösungen fallen demgemäß basische Sulfate aus. Bei niedrigen pH-Werten lässt es sich in Form fast farbloser Hydrate (n = 3, 6, 7, 9, 10, 12) auskristallisieren. Mit Alkali- oder Ammoniumsulfat bildet es Eisenalaune, z. B.: Ammoniumeisen(III)-sulfat (NH4)Fe(SO4)2·12 H2O, welcher in der Argentometrie als Indikator verwendet wird.[8]
Eisen(III)-sulfat ist thermisch nicht belastbar und spaltet beim Erhitzen SO3 ab.[10]
Verwendung
Eisen(III)-sulfat wird in Großkläranlagen[11] zur Deodorierung und zur Ausfällung von Phosphat (u. a. bei der Trinkwasseraufbereitung und der Industriewasserentsorgung) sowie in der Hüttenindustrie als Beizmittel (z. B. für Aluminium und Stahl) eingesetzt. In der Medizin ist eine blutstillende und adstringierende Wirkung bekannt.
Sicherheitshinweise
Eisen(III)-sulfat wurde 2015 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Eisen(III)-sulfat waren die Besorgnisse bezüglich Verbraucherverwendung, Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der möglichen Gefahr durch sensibilisierende Eigenschaften. Die Neubewertung sollte von Litauen durchgeführt werden, jedoch wurde die Neubewertung des Stoffs 2019 zurückgezogen, weil die Gefahren als gering eingeschätzt wurden.[12][13]
Einzelnachweise
- ↑ Eintrag zu FERRIC SULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. Dezember 2021.
- ↑ a b c d e f g Eintrag zu Eisen(III)-sulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-69.
- ↑ MSDS von MartinBaker (Memento vom 9. Juli 2008 im Internet Archive)
- ↑ Daniela Mauro, Cristian Biagioni, Marco Pasero, Henrik Skogby, Federica Zaccarini: Redefinition of coquimbite, AlFe3+3(SO4)6(H2O)12⋅6H2O. In: Mineralogical Magazine. Band 84, 2020, S. 275–282, doi:10.1180/mgm.2020.15 (englisch).
- ↑ Malcolm Back, Cristian Biagioni, William D. Birch, Michel Blondieau, Hans-Peter Boja und andere: The New IMA List of Minerals – A Work in Progress – Updated: May 2022. (PDF; 3,7 MB) In: cnmnc.main.jp. IMA/CNMNC, Marco Pasero, Mai 2022, abgerufen am 9. Mai 2022 (englisch).
- ↑ Richard P. Pohanish: HazMat Data For First Response, Transportation, Storage, and Security. John Wiley & Sons, 2005, ISBN 0-471-72610-9, S. 549 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Holleman/Wiberg: Band 2, Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide Band 2: Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide, Anhänge. Walter de Gruyter GmbH & Co KG, 2016, ISBN 978-3-11-049590-4, S. 1958 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Rochelle M. Cornell, Udo Schwertmann: The Iron Oxides Structure, Properties, Reactions, Occurrences and Uses. John Wiley & Sons, 2003, ISBN 3-527-30274-3, S. 526 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Peter Paetzold: Chemie eine Einführung. Walter de Gruyter, 2009, ISBN 978-3-11-020268-7, S. 856 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Patent DE60002011T2: Verfahren zur Herstellung einer wässrigen Eisen(III)-Sulfat-Lösung und ihre Verwendung als Wasserbehandlungsreagenz. Angemeldet am 20. Juni 2000, veröffentlicht am 29. Januar 2004, Anmelder: Taki Chemical Co. Ltd, Erfinder: Toshihiko Kakio, Tatsuo Tsukamoto.
- ↑ Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): diiron tris(sulphate), abgerufen am 6. März 2022.
- ↑ ECHA: Withdrawal, 19. März 2019.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Struktur des Fe3+-Ions