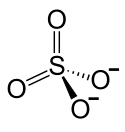
Caesiumsulfat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Kristallsystem | orthorhombisch | |||||||||||||||
| Raumgruppe | Pmcn (Nr. 62, Stellung 5) | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Caesiumsulfat | |||||||||||||||
| Andere Namen | Dicaesiumsulfat | |||||||||||||||
| Summenformel | Cs2SO4 | |||||||||||||||
| Kurzbeschreibung | weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 361,87 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||
| Dichte | 4,243 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | −1443,0 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Caesiumsulfat ist eine anorganische chemische Verbindung des Caesiums aus der Gruppe der Sulfate.
Gewinnung und Darstellung
Caesiumsulfat kann durch Reaktion von Caesiumcarbonat oder Caesiumchlorid mit Schwefelsäure oder Caesiumhydrosulfat gewonnen werden.[5]
Es entsteht auch beim Aufschluss von Pollucit mit Schwefelsäure.[6]
Eigenschaften
Caesiumsulfat ist ein weißer Feststoff, der löslich in Wasser ist.[1] Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pmcn (Raumgruppen-Nr. 62, Stellung 5). Bei 667 °C geht die Verbindung in eine Hochtemperaturform über, die eine trigonale Kristallstruktur mit der Raumgruppe P3m1 (Nr. 156) besitzt.[7]
Verwendung
Caesiumsulfat wird zur Herstellung für Dichte-Gradienten bei der Ultrazentrifugentrennung verwendet.[2]
Einzelnachweise
- ↑ a b c d e f g Datenblatt Cesium sulfate, 99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 21. Januar 2014 (PDF).
- ↑ a b G. W. A. Milne: Gardner's Commercially Important Chemicals: Synonyms, Trade Names, and ... John Wiley & Sons, 2005, ISBN 0-471-73661-9, S. 123 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Eintrag zu Cäsiumsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-10.
- ↑ Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 0-412-30120-2, S. 3097 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ von Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner: Industrielle Anorganische Chemie - Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner. John Wiley & Sons, 2013, ISBN 978-3-527-64958-7, S. 3.1.1.5.5. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 418 (eingeschränkte Vorschau in der Google-Buchsuche).