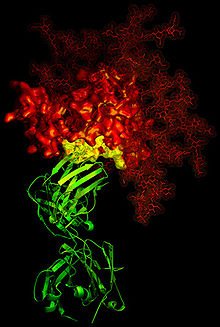
Breitneutralisierende Anti-HIV-Antikörper
Breitneutralisierende Anti-HIV-Antikörper (englisch broadly neutralizing anti-HIV-antibodies, bNAbs) sind gegen mehrere HIV-Stämme wirksame neutralisierende Antikörper.
Eigenschaften
Die meisten neutralisierenden Antikörper sind in ihrer Neutralisationswirkung spezifisch für einen Stamm. Breit neutralisierende Antikörper binden an konservierte Bereiche an der Oberfläche von Proteinen der Virusoberfläche. Die Erzeugung breitneutralisierender Anti-HIV-Antikörper ist ein Ziel des HIV-Impfstoffdesigns.[1] Breitneutralisierende Anti-HIV-Antikörper sind in den Online-Datenbanken bNAber[2] und LANL Antibody database aufgeführt. Die Neutralisationswirkung ist sowohl von der Bindung des bNAbs an virale Proteine als auch von der effizienten Bindung des bNAbs an den Fc-Rezeptor abhängig.[3] Eine effiziente Bindung an den FcRn (Isoform des Fc-Rezeptors), welcher vaginal und rektal vorkommt, kann die Neutralisation an der Eintrittspforte des HIV verstärken.[4]
Breitneutralisierende Anti-HIV-Antikörper können nach ihrer Bindungsstelle unterteilt werden, eine Bindung kann z. B. an den außen an die Transmembrandomäne angrenzenden Teil des GP41 (membrane-proximal external region, MPER),[5] an die Peptidoglykanschicht des GP120, an die Bindungsstelle von GP120 für den zellulären Rezeptor CD4[6][7][8] oder an die variablen Regionen des GP120 (V1–3) erfolgen.[9]
| Virales Epitop | Antikörperbindung | Antikörperbezeichnung | Veröffentlichungsjahr |
|---|---|---|---|
| MPER des gp41 | Sequenzepitop | 2F5 | 1992 |
| Sequenzepitop | 4E10 | 1994 | |
| Sequenzepitop | M66.6 | 2011 | |
| Sequenzepitop | CAP206-CH12 | 2011 | |
| Sequenzepitop | 10E8 l | 2012 | |
| V1V2-glycan | Peptidoglycan | PG9, PG16 | 2009 |
| Peptidoglycan | CH01–04 | 2011 | |
| Peptidoglycan | PGT 141–145 | 2011 | |
| Outer domain glycan | Nur Glycan | 2G12 | 1994 |
| V3-glycan | Peptidoglycan | PGT121–123 | 2011 |
| Peptidoglycan | PGT125–131 | 2011 | |
| Peptidoglycan | PGT135–137 | 2011 | |
| CD4-Bindungsstelle | CDRH3 loop | b12 | 1991 |
| HJ16 | 2010 | ||
| CDRH3 loop | CH103–106 | 2013 | |
| ähnelt CD4 via CDRH2 | VRC01–03 | 2010 | |
| ähnelt CD4 via CDRH2 | VRC-PG04, 04b | 2011 | |
| ähnelt CD4 via CDRH2 | VRC-CH30–34 | 2011 | |
| 3BNC117, 3BNC60 | 2011 | ||
| ähnelt CD4 via CDRH2 | NIH45–46 | 2011 | |
| 12A12, 12A21 | 2011 | ||
| 8ANC131, 134 | 2011 | ||
| 1NC9, 1B2530 | 2011 |
Literatur
- K. A. Finton, D. Friend, J. Jaffe, M. Gewe, M. A. Holmes, H. B. Larman, A. Stuart, K. Larimore, P. D. Greenberg, S. J. Elledge, L. Stamatatos, R. K. Strong: Ontogeny of Recognition Specificity and Functionality for the Broadly Neutralizing Anti-HIV Antibody 4E10. In: PLoS Pathogens. Band 10, Nummer 9, September 2014, S. e1004403, ISSN 1553-7374, doi:10.1371/journal.ppat.1004403, PMID 25254371, PMC 4177983 (freier Volltext).
- H. Mouquet: Antibody B cell responses in HIV-1 infection. In: Trends in Immunology. [elektronische Veröffentlichung vor dem Druck] September 2014, ISSN 1471-4981, doi:10.1016/j.it.2014.08.007, PMID 25240985.
- J. Mata-Fink, B. Kriegsman, H. X. Yu, H. Zhu, M. C. Hanson, D. J. Irvine, K. D. Wittrup: Rapid conformational epitope mapping of anti-gp120 antibodies with a designed mutant panel displayed on yeast. In: Journal of Molecular Biology. Band 425, Nummer 2, Januar 2013, ISSN 1089-8638, S. 444–456, doi:10.1016/j.jmb.2012.11.010, PMID 23159556, PMC 3785227 (freier Volltext).
Weblinks
Einzelnachweise
- ↑ K. A. Hassapis, L. G. Kostrikis: HIV-1 vaccine strategies utilizing viral vectors including antigen- displayed inoviral vectors. In: Current HIV Research. Band 11, Nummer 8, Dezember 2013, ISSN 1873-4251, S. 610–622, PMID 24517188.
- ↑ A. M. Eroshkin, A. LeBlanc, D. Weekes, K. Post, Z. Li, A. Rajput, S. T. Butera, D. R. Burton, A. Godzik: bNAber: database of broadly neutralizing HIV antibodies. In: Nucleic Acids Research. Band 42, Database issueJanuar 2014, S. D1133–D1139, ISSN 1362-4962, doi:10.1093/nar/gkt1083, PMID 24214957, PMC 3964981 (freier Volltext).
- ↑ S. Bournazos, F. Klein, J. Pietzsch, M. S. Seaman, M. C. Nussenzweig, J. V. Ravetch: Broadly neutralizing anti-HIV-1 antibodies require Fc effector functions for in vivo activity. In: Cell. Band 158, Nummer 6, September 2014, ISSN 1097-4172, S. 1243–1253, doi:10.1016/j.cell.2014.08.023, PMID 25215485, PMC 4167398 (freier Volltext).
- ↑ S. Y. Ko, A. Pegu, R. S. Rudicell, Z. Y. Yang, M. G. Joyce, X. Chen, K. Wang, S. Bao, T. D. Kraemer, T. Rath, M. Zeng, S. D. Schmidt, J. P. Todd, S. R. Penzak, K. O. Saunders, M. C. Nason, A. T. Haase, S. S. Rao, R. S. Blumberg, J. R. Mascola, G. J. Nabel: Enhanced neonatal Fc receptor function improves protection against primate SHIV infection. In: Nature. Band 514, Nummer 7524, Oktober 2014, ISSN 1476-4687, S. 642–645, doi:10.1038/nature13612, PMID 25119033.
- ↑ P. N. Reardon, H. Sage, S. M. Dennison, J. W. Martin, B. R. Donald, S. M. Alam, B. F. Haynes, L. D. Spicer: Structure of an HIV-1-neutralizing antibody target, the lipid-bound gp41 envelope membrane proximal region trimer. In: Proceedings of the National Academy of Sciences of the United States of America. Band 111, Nummer 4, Januar 2014, S. 1391–1396, ISSN 1091-6490. doi:10.1073/pnas.1309842111. PMID 24474763. PMC 3910588 (freier Volltext).
- ↑ H. X. Liao, R. Lynch, T. Zhou, F. Gao, S. M. Alam, S. D. Boyd, A. Z. Fire, K. M. Roskin, C. A. Schramm, Z. Zhang, J. Zhu, L. Shapiro, J. C. Mullikin, S. Gnanakaran, P. Hraber, K. Wiehe, G. Kelsoe, G. Yang, S. M. Xia, D. C. Montefiori, R. Parks, K. E. Lloyd, R. M. Scearce, K. A. Soderberg, M. Cohen, G. Kamanga, M. K. Louder, L. M. Tran, Y. Chen, F. Cai, S. Chen, S. Moquin, X. Du, M. G. Joyce, S. Srivatsan, B. Zhang, A. Zheng, G. M. Shaw, B. H. Hahn, T. B. Kepler, B. T. Korber, P. D. Kwong, J. R. Mascola, B. F. Ha: Co-evolution of a broadly neutralizing HIV-1 antibody and founder virus. In: Nature. Band 496, Nummer 7446, April 2013, S. 469–476, ISSN 1476-4687. doi:10.1038/nature12053. PMID 23552890. PMC 3637846 (freier Volltext).
- ↑ X. Wu, Z. Y. Yang, Y. Li, C. M. Hogerkorp, W. R. Schief, M. S. Seaman, T. Zhou, S. D. Schmidt, L. Wu, L. Xu, N. S. Longo, K. McKee, S. O'Dell, M. K. Louder, D. L. Wycuff, Y. Feng, M. Nason, N. Doria-Rose, M. Connors, P. D. Kwong, M. Roederer, R. T. Wyatt, G. J. Nabel, J. R. Mascola: Rational design of envelope identifies broadly neutralizing human monoclonal antibodies to HIV-1. In: Science Band 329, Nummer 5993, August 2010, S. 856–861, ISSN 1095-9203. doi:10.1126/science.1187659. PMID 20616233. PMC 2965066 (freier Volltext).
- ↑ T. Zhou, I. Georgiev, X. Wu, Z. Y. Yang, K. Dai, A. Finzi, Y. D. Kwon, J. F. Scheid, W. Shi, L. Xu, Y. Yang, J. Zhu, M. C. Nussenzweig, J. Sodroski, L. Shapiro, G. J. Nabel, J. R. Mascola, P. D. Kwong: Structural basis for broad and potent neutralization of HIV-1 by antibody VRC01. In: Science Band 329, Nummer 5993, August 2010, S. 811–817, ISSN 1095-9203. doi:10.1126/science.1192819. PMID 20616231. PMC 2981354 (freier Volltext).
- ↑ L. M. Walker, S. K. Phogat, P. Y. Chan-Hui, D. Wagner, P. Phung, J. L. Goss, T. Wrin, M. D. Simek, S. Fling, J. L. Mitcham, J. K. Lehrman, F. H. Priddy, O. A. Olsen, S. M. Frey, P. W. Hammond, S. Kaminsky, T. Zamb, M. Moyle, W. C. Koff, P. Poignard, D. R. Bu: Broad and potent neutralizing antibodies from an African donor reveal a new HIV-1 vaccine target. In: Science Band 326, Nummer 5950, Oktober 2009, S. 285–289, ISSN 1095-9203. doi:10.1126/science.1178746. PMID 19729618. PMC 3335270 (freier Volltext).
- ↑ J. R. Mascola, B. F. Haynes: HIV-1 neutralizing antibodies: understanding nature's pathways. In: Immunological Reviews. Band 254, Nummer 1, Juli 2013, ISSN 1600-065X, S. 225–244, doi:10.1111/imr.12075, PMID 23772623, PMC 3738265 (freier Volltext).
Auf dieser Seite verwendete Medien
Autor/Urheber: Pablo.gainza, Lizenz: CC BY-SA 3.0
Water mediated hydrogen bonds play a key role in protein-protein binding between GP120 and the broadly neutralizing antibody GP120. One such interation is shown between residues D457, S365 in the heavy chain of the broadly neutralizing antibody VRC01 (green) and residues N58 and Y59 in the HIV envelope protein GP120 (purple). Zhou, Tongqing, et al. "Structural basis for broad and potent neutralization of HIV-1 by antibody VRC01." Science 329.5993 (2010): 811-817.
Ligand-receptor binding. HIV-1 gp120 glycoprotein ligand (red); CD4-glycoprotein receptor (yellow); b12 antibody-protein ligand (green)