Biofilm


Biofilme bestehen aus einer Schleimschicht (einem Film), in der Mischpopulationen[1] (vgl. Konsortien) von Mikroorganismen (z. B. Bakterien, Algen, Pilze, Protozoen) in Konzentrationen von 1012 Zellen je Milliliter Biofilm[1] und von mehrzelligen Organismen[1] wie Rädertierchen, Fadenwürmern, Milben, Wenigborstern oder Insektenlarven, die sich von den Mikroorganismen ernähren, eingebettet sind. Sie werden im Alltag oft als sich glitschig-weich anfühlende, wasserhaltige Schleimschicht oder Belag wahrgenommen. Andere, umgangssprachliche Bezeichnungen sind Aufwuchs, Kahmhaut oder Sielhaut.
Beschreibung
Biofilme bilden sich überwiegend in wässrigen Systemen, wenn sich dort Mikroorganismen an Grenzflächen ansiedeln. Grundsätzlich können alle Flächen von Biofilmen bewachsen werden: zwischen Gas- und Flüssigphasen (z. B. freier Wasserspiegel), Flüssig- und Festphasen (z. B. Kies an der Gewässersohle) oder auch zwischen verschiedenen Flüssigphasen (z. B. Öltröpfchen im Wasser). Die Grenzfläche, auf der sich der Biofilm bildet, oder genauer die Phase in die der Film nicht oder kaum hineinwächst bildet das Substratum (Substrat; das darunter sich Erstreckende).
Im erweiterten Sinn werden als Biofilm alle Aggregate von Mikroorganismen bezeichnet, die in eine von ihnen gebildete Schleimschicht eingebettet sind.[2] Schwebstoffe in Gewässern bestehen oft aus mineralischen Partikeln, die von Biofilmen bewachsen sind. Auch der Belebtschlamm in Kläranlagen hat wesentliche Eigenschaften eines Biofilms. Er besteht aus Flocken, die selber eine zur Besiedlung geeignete Oberfläche haben.

Biofilme können als eine sehr ursprüngliche Form des Lebens gelten, denn die ältesten Fossilien, die man bisher gefunden hat, stammen von Mikroorganismen in Biofilmen, die vor 3,2 Milliarden Jahren gelebt haben. Es handelt sich dabei um in Westaustralien (Pilbara Kraton) gefundene Stromatolithen (biogene Sedimentgesteine). Der Biofilm als Lebensform hat sich so gut bewährt, dass er bis heute weit verbreitet ist. Die weitaus überwiegende Zahl an Mikroorganismen lebt in der Natur in Form von Biofilmen.[4][FSE 1]
Zusammensetzung

Cytoplasma (CP) eines sphaeroplastierten Bakteriums mit Cytoplasmamembran (CPM).
Interzellulare (IC) Glykokalyx mit Exo-Polysacchariden (EPS), DNS (DNA), hydrophoben (HPr) und wasserlöslichen Proteinen (SPr).
Periplasmamembran (PPM), Zellwand (W), Periplasma (PPl), Cytoplasmamembran und Cytoplasma eines Bakteriums.
Der Biofilm enthält außer den Mikroorganismen hauptsächlich Wasser. Von den Mikroorganismen ausgeschiedene extrazelluläre polymere Substanzen (EPS) bilden in Verbindung mit Wasser Hydrogele, so dass eine schleimartige Matrix entsteht, in der Nährstoffe und andere Substanzen gelöst sind. Oft werden von der Matrix auch anorganische Partikel oder Gasbläschen eingeschlossen. Die Gasphase kann je nach Art der Mikroorganismen mit Stickstoff, Kohlenstoffdioxid, Methan oder Schwefelwasserstoff angereichert sein.
Die EPS bestehen aus Biopolymeren, die in der Lage sind, Hydrogele zu bilden und die somit dem Biofilm eine stabile Form geben. Dabei handelt es sich um ein weites Spektrum von Polysacchariden, Proteinen, Lipiden und Nukleinsäuren (extrazelluläre DNA).
In Biofilmen leben normalerweise verschiedene Mikroorganismenarten gemeinsam. Neben den ursprünglichen Biofilm-Bildnern können auch andere Einzeller (Amöben, Flagellaten u. a.) integriert werden. Im Abstand von wenigen hundert Mikrometern können aerobe und anaerobe Zonen vorkommen, sodass aerobe und anaerobe Mikroorganismen eng nebeneinander leben können.
Form

Im Kernbereich ist der Biofilm meist kompakt (Basis-Biofilm). Der Randbereich (Oberflächen-Biofilm) kann entweder ebenfalls kompakt und regelmäßig geformt sein und eine ebene Grenzfläche zum überströmenden Fluid bilden oder unscharf ausgeformt und wesentlich lockerer sein. In letzterem Fall kann der Oberflächen-Biofilm einer Berg-und-Tal-Bahn ähneln, wenn beispielsweise Bakterienarten fadenförmig (filamentös) in das Fluid hineinwachsen oder wenn das Substratum mit Protozoen (z. B. Glockentierchen) oder höheren Organismenarten besiedelt ist.
Die Biofilm-Matrix ist dann oft von Poren, Kavernen und Gängen durchzogen, die einen Stoffaustausch zwischen den Bakterienzellen und eine Versorgung mit Wasser ermöglichen. So finden sich häufig pilzförmige oder turmartige Strukturen. Dort treten konvektive Stofftransportvorgänge auf, wenn diese von Flüssigkeit durchströmt werden. Im Bereich der Oberfläche des Biofilms können konvektive Mischungsvorgänge zusätzlich durch Bewegung von in die Strömung hineinragenden Auswüchsen (z. B. „Abwasserpilze“ wie Sphaerotilus natans) ausgelöst werden. Im Inneren von Biofilmen werden gelöste Stoffe überwiegend durch Diffusion transportiert. An der Grenzschicht zum Wasser können immer wieder Zellen oder ganze Teile des Biofilms abgegeben und vom vorbeiströmenden Wasser aufgenommen werden.
Bildung und Reifung von Biofilmen
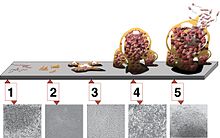
Die Entstehung und Ausbildung eines Biofilms kann in drei Phasen unterteilt werden: Die Induktionsphase (Abb. 4 und 6, 1–2) die Akkumulationsphase (3) und die Existenzphase (4–5).
Besiedlung von Oberflächen
Typische Mikroorganismen haben nach landläufiger Vorstellung Geißeln (Abb. 6, 1) und bewegen sich frei in der Wassersäule. Tatsächlich handelt es sich bei solchen Schwärmerzellen[FSE 3] in der Regel nur um das Verbreitungsstadium von Biofilm-Bewohnern.
Dass die absolute Mehrheit von Bakterien und Archaeen in Biofilmen verwurzelt ist, hat einen zwingenden Grund: Sie würden ansonsten vom lebensnotwendigen Wasser aus ihrem Biotop herausgewaschen. Bodenbakterien würden im nächsten Fluss landen und von dort aus ihre letzte Reise ins Sediment eines Ozeans antreten. Ebenso erginge es den Mikroorganismen im Belebtschlamm von Kläranlagen.
Um überhaupt das freie Wasser verlassen zu können, benötigen Mikroorganismen wasserabweisende hydrophobe Substanzen an der Oberfläche ihrer Zellen. Diese ermöglichen den Organismen eine auf Van-der-Waals-Kräften beruhende Anheftung an hydrophobe Flächen. Da nahezu alle Flächen in aquatischen Biotopen mit Biofilmen bewachsen sind[FSE 4], assoziieren sich die meisten Schwärmerzellen mit vorhandenen Biofilmen.
Solche Organismen können sich aber auch an unbesiedelte Flächen direkt anheften. Glatte hydrophobe Flächen, wie z. B. Polystyrol oder die Cuticula von vielen Pflanzen können direkt besiedelt werden, allerdings nur, wenn sie mit Wasser benetzbar sind. Durch den Lotuseffekt vermeiden allerdings viele Pflanzen den Bewuchs ihrer Blätter durch Mikroorganismen.
An leere hydrophile Oberflächen lagert sich zunächst eine dünne, zähflüssige Schicht aus organischen Substanzen an. Diese Biopolymere entstammen den Schleimhüllen, die sich um Bakterienzellen bilden (EPS), sich gelegentlich ganz oder teilweise ablösen und beim Kontakt mit Grenzflächen adsorptiv gebunden werden. Solche biogenen Substanzen sind in der Natur allgegenwärtig.[FSE 5]
Die Metamorphose zum Biofilm-Bewohner


1: Erstbesiedlung einer Fläche durch eine begeißelte Zelle. 2. Beginn der Biofilmbildung durch Zelladhäsion. 3. Exponentielles Wachstum. 4-5. Teilausschnitte der Oberfläche des Biofilms. 4. Nährstoffmangel im Zentrum. 5. Phase der Auswanderung durch Sporulation und begeißelte Zellen.
Wenn der Ort der Anheftung das Wachstum des jeweiligen Organismus ermöglicht, wirft er in der Regel seine Geißel(n) ab. Bei vielen Organismen tritt allerdings noch eine wesentlich tiefer gehende Veränderung ein.
Deutlich sichtbar ist diese bei Caulobacter, einem aeroben α-Proteobacterium. Nach Verlust der Geißel zieht die Schwärmerzelle ihre der Anheftung dienenden Pili ein und wird zur Stielzelle. Die ist im Gegensatz zur Schwärmzelle teilungsfähig und beginnt sofort mit einer asymmetrischen Teilung. Bei der entsteht eine neue Schwärmerzelle. Nach der Trennung kann die Stielzelle bei geeigneten Bedingungen immer wieder neue Schwärmerzellen bilden.[FSE 7]
Mindestens ebenso tiefgreifend sind die Veränderungen bei dem Bodenbakterium Bacillus subtilis (Abb. 6). Nach Anheftung und Verlust der Begeißelung entstehen bei nachfolgenden Zellteilungen fädige Strukturen, weil die Zellwände der Organismen nicht getrennt werden. Gleichzeitig werden Polymere ausgeschieden, die dem entstehenden Film eine seitliche Festigkeit geben. Solche Veränderungen werden epigenetisch ausgelöst.[6]
Infolge der Vermehrung der Zellen, die sich an einer Oberfläche angelagert haben, kommt es zu einer Ausbreitung der Organismen. Die Grenzfläche wird in Form eines Films (Biofilm) erst flächig besiedelt. Gleichzeitig oder später wachsen die Biofilme mehrschichtig auf und bilden schließlich heterogene dreidimensionale Strukturen. Bacillus subtilis produziert bis zu dieser Phase nahezu ausschließlich fädige Zellverbände.
Konkurrenzvermeidung
Zwischen den Zellen eines Biofilms herrscht im Prinzip eine Konkurrenz um Nährstoffe, bei denen diejenigen Zellen einen klaren Vorteil haben, die der Nahrungsquelle am nächsten sind. Dagegen drohen die Zellen im Inneren zu verhungern. Passiert das, dann sind sie nicht mehr in der Lage, den Zusammenhalt aufrechtzuerhalten. Tatsächlich gibt es Mechanismen der Zelldichteregulation und der Kommunikation zwischen den Zellen (Quorum Sensing)[FSE 8], die dem entgegenwirken.
Für Bacillus subtilis wurde 2015 solch ein Mechanismus erstmals im Detail aufgeklärt.[7] Dafür wurde ein Biofilm aus einer Reinkultur dieser Bakterien in einem Chemostat-Bioreaktor untersucht. Der Biofilm wurde kontinuierlich mit Nährstoffen versorgt, und dennoch unterbrachen die Zellen ihr Wachstum periodisch, bis die Zellen im Inneren des Biofilms aufhörten zu hungern. Dieser „Oszillation“ liegt folgender Ablauf zugrunde:
- Hungernde Zellen im Biofilm-Inneren senden einen Impuls von K+-Ionen aus. Für diese Ionen verfügen die Biofilm-Zellen von B. subtilis über Rezeptoren, die eine ganze Ereigniskette auslösen.
- Alle, auch die gut versorgten Zellen, senden unmittelbar nach Empfang selbst ein K+-Signal aus. Für die Ausbreitung der Signale existieren im Biofilm spezifische K+-Kanäle. (Eine normale Diffusion durch die polymere Biofilm-Matrix wäre zu langsam.)
- Die noch gut versorgten Zellen unterbrechen sofort ihr Wachstum, aber nicht ihre Stoffwechselaktivität. Bei Stickstoffmangel nehmen sie z. B. Glutamin aus dem Nährmedium auf, verwenden aber diese Aminosäure nicht zum Wachsen, sondern spalten daraus Ammonium ab, den sie dem Biofilm zur Verfügung stellen.
- Lassen die Signale nach, wird das Wachstum gemeinsam fortgesetzt.[8]
Die Kommunikation zwischen Bakterienzellen auf K+-Basis ist nicht die einzige. Es gibt eine Reihe von Pheromonen, die von den Organismen gebildet und wahrgenommen werden können. Durch diese wird auch die nächste Phase in der Existenz eines Biofilms eingeleitet (siehe Abb. 6,5). Wieder tritt eine Metamorphose von Zellen ein. Im gut versorgten werden wieder begeißelte Schwärmzellen gebildet, deren bevorzugte Schwimmrichtung zur Nährstoffquelle ist. Viele Bakterien bilden wie B. subtilis in dieser Phase auch Sporen. Diese werden von der Strömung mitgetragen und sind auf lang anhaltenden Nährstoffmangel vorbereitet.[FSE 9]
Diese Phase der Auswanderung ist keineswegs das Ende eines Biofilms. Für die Freisetzung der Sporen und Schwärmerzellen wird nur in deren Umgebung die Extrazelluläre Matrix aktiv aufgelöst. Im alten Teil des Biofilms geht das Leben weiter mit einer neuen Phase des Wachstums.
Dass die Tiefenausdehnung des Biofilms begrenzt ist zeigt sich, wenn ganze Teile des Biofilms von der Strömung mitgerissen werden. Durch die Bildung von Gasblasen (z. B. durch Denitrifikation und Kohlendioxid) geht der Zusammenhalt von Biofilmteilen verloren. Die Erhöhung des Strömungswiderstandes mit zunehmender Dicke führt zu einer erhöhten Erosion, wenn sich der Biofilm an angeströmten Oberflächen gebildet hat. Das Leben in solchen Biofilm-Fragmenten unterscheidet sich nicht prinzipiell von Biofilmen, die irgendwo angeheftet sind. Solche Flocken besitzen alle Eigenschaften für die Anheftung an eine neue Fläche.
Leben im Biofilm – Schutz und Gemeinschaft

Die Lebensvorgänge der Bakterien im Biofilm unterscheiden sich deutlich von denen im planktonischen Zustand, also in freier Suspension. Von den beweglichen Schwärmerzellen werden andere EPS als im Biofilmzustand gebildet.
Die Matrix bietet mechanische Stabilität und erlaubt es den Biofilm-Organismen, langfristige synergistische Wechselwirkungen aufzubauen, Hungerperioden zu überstehen und verhindert das Abschwemmen extrazellulärer Enzyme.

So werden einige Gene durch den Oberflächenkontakt an- und andere abgeschaltet. Durch spezielle Signalmoleküle können sie sich untereinander verständigen und gegenseitig weitere Gene an- und abschalten. Ihr genetisches Repertoire erweitern sie durch horizontalen Gentransfer, indem sie mit Nachbarzellen Gene austauschen.
Dadurch ist eine flexible, leistungsfähige und universelle Lebensform entstanden, die durchaus mit multizellulären Organismen verglichen wird.[9][10]
Der Biofilm bietet dem einzelnen Mikrolebewesen darin einen ausgezeichneten Schutz und ermöglicht ihm, sich auf veränderte Umweltbedingungen einzustellen: So steigt die Toleranz gegenüber extremen pH- und Temperatur-Schwankungen, Schadstoffen (z. B. Bakteriziden), aber auch UV- und Röntgenstrahlung sowie Nahrungsmangel.
Mögliche Ursachen dieser Hemmung schädlicher Umwelteinflüsse sind:
- erschwerte Penetration – die Schadstoffe können nicht in die Biofilme eindringen
- ungünstige Bedingungen für den Wirkstoff im Biofilm
- hohe Diversität der Bakterien im Biofilm
- unterschiedliches Verhalten einzelner bakterieller Zellen oder Gruppen an verschiedenen Stellen des Biofilms (mit anderen Worten „näher“ oder „weiter entfernt“ von Nährstoffen, Sauerstoff (aerobe und anaerobe Bereiche), Antibiotika oder Reaktionen des Immunsystems) – Selbst bei großflächigem Bakteriensterben überleben häufig vereinzelte so genannte „Persister“, die aufgrund der vorhandenen Nährstoffe nahezu ideale Bedingungen für eine erneute Vermehrung haben.[11]
- langsamere Wachstumsraten der Bakterien im Biofilm – Die Bakterien zeigen teilweise einen reduzierten Stoffwechsel bis hin zu Ruhestadien (VBNC – „viable but not culturable“)[12] und nehmen deshalb so gut wie keine antibiotischen Gifte auf, sie schützen sich im Wesentlichen selbst durch Untätigkeit.
Vorkommen
Natürliches Vorkommen
Biofilme kommen überall vor – in allen Böden und Sedimenten, auf Gestein, auf und in Pflanzen und Tieren, hier insbesondere an den Schleimhäuten; im Eis von Gletschern, in kochenden Quellen, auf Felsen in der Wüste, in verdünnter Schwefelsäure und verdünnter Natronlauge, in Rohren und Röhrchen, in Flugzeugbenzin und in Öltanks, in Raumschiffen[13] und U-Booten, sogar in stark radioaktiv kontaminierten Bereichen von Kernkraftwerken. Sie bilden mikrobielle Matten in Feuchtgebieten.
Biofilme besitzen eine große ökologische Bedeutung. Sie sind an den globalen Kreisläufen von Kohlenstoff, Sauerstoff, Stickstoff, Schwefel, Phosphor und vieler anderer Elemente beteiligt. Sie mobilisieren Stoffe aus Mineralen. Sie binden viel Kohlenstoffdioxid, womit sie dem Treibhauseffekt entgegenwirken.
Die Organismen innerhalb der Biofilme sind in der Lage, durch ihr Zusammenwirken auch schwer abbaubare Stoffe abzubauen. Sie spielen eine zentrale Rolle in den Selbstreinigungsprozessen natürlicher Habitate. So sind sie wesentlich an der Selbstreinigung der Gewässer beteiligt.
An Grenzflächen bzw. Körperöffnungen von Tieren gibt es häufig „einheimische“, nicht-krankheitserregende (apathogene) Biofilm-Populationen. Beispiele hierfür sind die Bakteriengemeinschaften von Haut, Mund und Darm (Haut-, Mund- und Darmflora). Auch die Plaque, der Zahnbelag, der sich auf Zähnen bildet, stellt einen Biofilm dar.[14] Die beteiligten Bakterien gehen mit dem Wirt eine interspezifische Wechselbeziehung ein. Sie gelten als Kommensale, sobald sie vom Wirt profitieren. Profitieren beide Arten, handelt es sich um Mutualismus. Bei dieser Form der Wechselbeziehung erfüllen die Bakterien eine Reihe von Aufgaben. So sind sie bei der Reifung des Immunsystems in den ersten Lebensjahren von Bedeutung. Außerdem werden potenziell krankheitserregende Bakterien ferngehalten oder die Verdauungsprozesse unterstützt. Kommt es zu einem Ungleichgewicht in der Population, kann dies zu Krankheiten führen.
Infektionskrankheiten

Obwohl Biofilme in der Natur allgegenwärtig sind, wird ihre klinische Bedeutung in der Medizin häufig unterschätzt. Dies gilt insbesondere für Infektionen, denn in mehr als 60 % aller bakteriellen Infektionskrankheiten schützen sich die Erreger durch die Bildung von Biofilmen vor dem Immunsystem.[15] Da ein großer Teil des anfänglichen mikrobiologischen Instrumentariums im Zuge großer Seuchen entwickelt wurde, geschah dies mit Schwerpunkt auf den frei schwebenden (planktonischen), sich schnell teilenden Bakterien akuter Infektionen (siehe Henle-Koch-Postulate). Die hier geforderte Isolation und Reinkultur im Labor führt allerdings zu beträchtlichem Genverlust der Bakterien unter herkömmlichen Laborbedingungen und schließlich zum Verlust der Fähigkeit zur Biofilmbildung. Deswegen und aufgrund der oben erwähnten Ruhephasen entziehen sich Biofilme in der Akkumulationsphase häufig neben dem Nachweis durch konventionelle Verfahren der Mikroorganismenkultur auch der eingehenderen Untersuchung.[16] Moderne Techniken zur Visualisierung wie konfokale Mikroskopie und Gensonden zur Lokalisierung und Identifizierung von Biofilm-Organismen mittels Fluoreszenzmikroskopie haben zu einem besseren Verständnis der Biofilme beigetragen.
Im Zuge der Biofilmreifung kommt es in der Existenzphase, koordiniert durch das Quorum sensing, zum Ablösen größerer Bakterienansammlungen. Dadurch entsteht eine Quelle für Keime, die zu chronischen und wiederkehrenden Infektionen von Patienten (Bakteriämie) und unter Umständen bis hin zur häufig tödlichen Sepsis führen. Dies gilt insbesondere für Patienten mit geschwächtem Immunsystem. Biofilme werden mit einer Reihe von Infektionen in Verbindung gebracht. Beispiele hierfür sind:[4][17][18]
- chronische Lyme-Borreliose, mit oder ohne Nervenbefall (Neuroborreliose bzw. Lyme-Neuroborreliose)
- Osteomyelitis
- Wundinfektionen
- bakterielle Endokarditis
- Parodontitis
- Urethritis
- Prostatitis
- Zahnkaries
- Periimplantitis
- chronische Mittelohrentzündung bei Kindern[19]
- Bakterielle Vaginose
Ein weiteres betroffenes Feld sind die Fremdkörper-assoziierten Infektionen. Hierunter fallen die mikrobielle Kontamination und Besiedlung von Kathetern, Implantaten und medizinischen Instrumenten. Der zunehmende Einsatz von Kunststoffen in der Medizintechnik hat neben den großen inhärenten Vorteilen für Diagnostik und Therapie zu einer Verschärfung der Biofilm-Problematik geführt. Besonders wegen der Affinität verschiedener Mikroorganismen, wie einigen Staphylokokken, zu den Oberflächen von Biomaterialien sind etwa die Hälfte der nosokomialen Infektionen auf chirurgische Implantate zurückzuführen.[20] Als Ausgangspunkt der beteiligten Mikroorganismen gelten die Hautoberfläche von Krankenhauspersonal und Patienten, der Kontakt von Austrittsstellen oder Konnektoren mit Leitungswasser und weitere Quellen aus der Umgebung.[21] Auch die Wasserleitungen von Krankenhäusern und zahnärztlichen Behandlungseinheiten sowie Dialyse-Ausrüstung und schwer zu reinigende Endoskope können betroffen sein. Abhängig von dem verwendeten Medizinprodukt und der Verweildauer kommen grampositive, gramnegative Bakterien und Pilze als Einzel- oder Multi-Spezies-Biofilm vor. Beispiele für häufig beteiligte Erreger sind:
- Borrelia burgdorferi, andere humanpathogene Arten von Borrelien (B. garinii, B. afzelii, B. valaisiana, B. lusitaniae und B. spielmanii)
- Staphylococcus epidermidis
- Staphylococcus aureus
- Pseudomonas aeruginosa
- Escherichia coli
- Candida albicans
Aufgrund der teilweise ungeklärten erhöhten allgemeinen und Antibiotikum-Resistenz der Bakterien im Biofilm (u. a. durch verstärkten horizontalen Gentransfer, Bildung von „Persistern“ und hoher Diversität – siehe oben) ist in vielen Fällen die Entfernung des jeweiligen Implantats erforderlich. Besonders gefährdet sind Systeme mit großen Oberflächen und mit Hautdurchtrittsstellen. Beispiele für häufig von Fremdkörper-assoziierten Infektionen betroffene Medizinprodukte sind:[4]
- Venenkatheter
- künstliche Herzklappen
- Gelenkprothesen
- Peritonealdialyse-Katheter
- Herzschrittmacher
- Endotrachealtubi
- Stimmprothesen[22]
- Zerebrospinalflüssigkeit-Shunts
- Zahnimplantate[23]
Durch die Verwendung von Verfahren und Herangehensweisen aus der mikrobiellen Ökologie werden für die medizinische Mikrobiologie laut J. W. Costerton (siehe Literatur) erhebliche Synergien und damit ein deutlicher Fortschritt bei Verständnis und Therapie von medizinisch relevanten Biofilmen erwartet.
Wunden
Auf 60-90 % der chronischen Wunden sind Biofilme nachweisbar.[24] Sie spielen eine Schlüsselrolle in der Entwicklung einer unauffälligen Gewebsschädigung zu einer chronischen Wunde.[25] Ein Biofilm, der den Wundgrund bedeckt, stört den Abheilungsprozess und gefährdet zudem die Betroffenen, deren Immunstatus durch die chronische Wunde oder die ihr zu Grunde liegende Erkrankung eingeschränkt ist. Die Beseitigung des Biofilms ist somit grundsätzlicher Bestandteil der Wundversorgung.[25] Zur Entfernung des Biofims kommen Maßnahmen des Débridements zum Einsatz, beispielsweise therapeutische Larven oder eine Ultraschall-gestützte Wundreinigung. Die anschließende lokalantiseptische Nachbehandlung der Wunde beugt der Rekonstruktion des Biofilms auf dem Wundgrund vor.[26]
Lebensmittel
Um die Kontamination von Wasser und Lebensmitteln, aber auch von Medikamenten und Kosmetika durch Mikroorganismen zu verhindern, sind ständige Maßnahmen gegen Biofilmbildung nötig. Dabei fallen jedes Jahr große Mengen durch Reinigungs- und Desinfektionsmittel belasteten Wassers an.
Biokorrosion
In Gegenwart von Biofilmen wird Biokorrosion beobachtet. Hierbei führen in der sauerstoffliebenden (aeroben) Deckschicht enthaltene Eisenoxidierer zu einem Angriff der Passivschicht (von Metallen) – in der anaeroben Schicht existierende Sulfatreduzierer setzen an diesen Stellen an und „fressen“ sich in das Material hinein.
Durch mikrobiologisch bedingte Korrosion entstehen jährlich wirtschaftliche Schäden in beträchtlichen Umfang. Der Anteil an der Gesamtkorrosion (d. h. abiotisch und biotisch verursachter Korrosion) wird auf mindestens 20 % geschätzt; er liegt nach neueren Erkenntnissen wahrscheinlich deutlich höher. Selbst höherlegierte Werkstoffe wie V2A und V4A werden geschädigt. Fast alle technischen Systeme sind davon betroffen: u. a. Kühlkreisläufe, Wasseraufbereitungs- und Brauchwassersysteme, die Energieerzeugung in Kraftwerken, die Produktion von Autos, Computern, Farben, die Öl- und Gasindustrie.[27] In Bergbaualtlasten führt biologische Laugung von Mineralen durch Biofilme zu großflächigen Umweltschäden bei Böden, Gewässern und Luft durch Staubbelastung sowie Emission von Schwefelsäure, Schwermetallen, Radon und Radionukliden.
Biofouling
Bei der Wasseraufbereitung durch Membranverfahren sind Biofilme für das Biofouling verantwortlich, das bei dieser Technik zu schwerwiegenden Störungen führt.
Ebenfalls unter Biofouling fallen Biofilme, die sich an Unterwasserkörpern bilden. Dies kann zu erheblichen Problemen führen. Ein Biofilm von nur einem Zehntel Millimeter verringert durch einen erhöhten Reibungswiderstand die Geschwindigkeit eines Tankers um 10 bis 15 Prozent. Dies hat einen erhöhten Brennstoffverbrauch zur Folge. Im Kampf gegen den organischen Bewuchs (bis hin zu Seepocken und Miesmuscheln) werden spezielle Substanzen auf Schiffe, Plattformen und Bojen gestrichen, deren Wirkstoffe an das Wasser abgegeben werden und häufig eine erhebliche Umweltbelastung darstellen. Eine solche Substanz ist das inzwischen weltweit verbotene hochtoxische Tributylzinn (TBT). Ebenfalls betroffen sind Sensorsysteme für Forschungs- oder Überwachungszwecke im maritimen Bereich, bei denen ein Bewuchs sehr schnell zu Funktionsbeeinträchtigungen führen kann.
Konzentrations-Gradienten von physisch-chemischen Parametern in Biofilmen können mittels hochauflösenden Mikrosensoren ermittelt (= Funktionsuntersuchung) und mit molekularbiologischen Daten aus der tiefenmäßigen Verteilung der im Biofilm vorhandenen mikrobiellen Populationen (= Strukturuntersuchung) korreliert werden. Ideelles Ziel ist es die Struktur und Funktion der mikrobiellen Populationen im Biofilm mit (Schadens-/Korrosions-)Daten von der Aufwuchsfläche zu kombinieren. Dieses trägt zum besseren Verständnis der Wechselwirkung zwischen schadensverursachendem Biofilm und der Aufwuchsfläche, was vor allem in angewandten Systemen von besonderem Interesse ist (z. B. marine Biofilme in Stahlrohren[27]), bei.
Biofilme in Verdunstungskühlanlagen
In Verdunstungskühlanlagen können Biofilme zur Gesundheitsbeeinträchtigung der Beschäftigten führen. Pseudomonas aeruginosa gehört zu den Erstbesiedlern von Biofilmen und kann entzündliche Erkrankungen hervorrufen. Insbesondere bei Reinigungs- und Instandhaltungsarbeiten kann es zu direktem Kontakt mit Haut und Atemwegen kommen.[28]
Nutzung
Die Biotechnologie macht sich Grenzflächen bereits in vielfacher Weise nutzbar. Dies reicht vom Einsatz immobilisierter, d. h. oberflächengebundener Enzyme und Mikroorganismen über die Abwasserreinigung mit Biofilm-Reaktoren und die biologische Abfallbehandlung bis zur mikrobiellen Laugung von Erzen.
Essigherstellung
Eines der bestbekannten Beispiele für die industrielle Nutzung von Biofilmen dürfte die Essigherstellung mit Hilfe von Essigbakterien sein, die, entweder als Kahmhaut auf einer alkoholhaltigen Flüssigkeit (Orléans-Verfahren) oder auf Holzspänen angesiedelt (Generatorverfahren), einen Ethanol zu Essigsäure umsetzenden Biofilm bilden.
Einsatz in der Abwassertechnik
Die Nutzung immobilisierter Mikroorganismen zur Abwasserreinigung in Form von Biofilmen begann bereits im 19. Jahrhundert. Biofilmverfahren eignen sich sehr gut für die Abwasserreinigung. Die Mikroorganismen sind an eine Feststoff-Oberfläche gebunden und werden somit nicht vollständig mit dem Abwasser aus der Kläranlage ausgetragen. Aufgrund von Biofilmwachstum werden jedoch überschüssige und abgestorbene Mikroorganismen mittels Scherkräften vom Biofilm abgelöst und ausgetragen. In der Regel werden Biofilmverfahren deshalb eine Filtrationsstufe nachgeschaltet.
Die das Wasser verunreinigenden Stoffe sind für Mikroorganismen Energiequelle und Nahrung. Biofilme mit ihrer verästelten Struktur besitzen eine sehr große Adsorptionsfläche. Dadurch können Stoffe, die nicht sofort verarbeitet werden können, bis zu einem gewissen Grad am Biofilm angelagert und nachfolgend in Perioden mit geringer Nahrungszufuhr abgebaut werden.
Nach den jeweiligen Reaktortypen unterscheidet man Tropfkörper, Scheibentauchkörper, aerobe und anaerobe Festbetten und Schwebebetten.
Biologische Abfallbeseitigung
Biofilme machen die biologische Abfallbeseitigung möglich, indem sie die Abfälle besiedeln und abbauen.
Biologische Abgasreinigung
Bei der Abgasreinigung mittels Biorieselbettreaktor wird ein Biofilm genutzt, um die in die wässrige Phase übergangenen Luftschadstoffe abzubauen.[29]
Bodensanierung
Selbst Bodenschadstoffe wie ausgelaufenes Öl können von den entsprechenden Mikroorganismen zersetzt werden.
Verhindern/Bekämpfen von Biofilmen
Mehrere unabhängige Institute bestätigen, dass sich bei der nachhaltigen Beseitigung von Biofilmen in technischen Systemen die Wasserentkeimung mit Vollmetallkatalysatoren in Verbindung mit geringem Einsatz an Wasserstoffperoxid seit mehr als zehn Jahren (erster technischer Einsatz 1997) erfolgreich im technischen Einsatz bewährt. Durch biochemische Verwertung von Keimen werden am Katalysator Biotenside gebildet, die den arteigenen Biofilm eliminieren.[30]
Andere Institute dagegen stellen fest, dass der alleinige Einsatz von Wasserstoffperoxid keine Wirksamkeit in Bezug auf die Entkeimung hat.[31] Eine H2O2 – Konzentration von 150 mg/L mit einer Kontaktzeit von 24 h zeigte bei der Desinfektion von Trinkwassersystemen weder eine abtötende noch eine ablösende Wirkung, auch nicht durch die Zugabe von Silberionen (150 µg/L).[32] Da durch die Biozidbehandlungen Biofilme nicht abgelöst wurden, sondern die tote Biomasse auf den Oberflächen verblieb, kommt es durch eine Selektion resistenter einzelner Organismen („Persister“) und den Eintrag neuer Organismen in das Versuchssystem schnell zu einer Wiederverkeimung.
Einen guten Biofilm-Abbau zeigt das Desinfektionsmittel Chlordioxid. Das Molekül ist elektrisch neutral und kann die EPS-Schicht von Biofilmen sowie die Zellmembranen von Mikroorganismen durchdringen. Im Gegensatz dazu erweist sich elementares Chlor, das in Wasser zu Salzsäure und Hypochloriger Säure disproportioniert, als deutlich weniger wirksam, da es in Abhängigkeit vom pH-Wert teilweise als Hypochlorit-Ion vorliegt und dieses – bedingt durch seine negative Ladung – eine Biofilm- und Zellmembrandurchdringung nicht mehr zuverlässig gewährleistet.
Darüber hinaus gibt es seit wenigen Jahren das Verfahren der lichtinduzierten Katalyse zur Wasserbehandlung. In Anlehnung an natürliche Vorgänge aus der Natur werden wasserführende Systeme in Gegenwart eines geeigneten Katalysators unter Einfluss von Tageslicht in einem biofilmfreien Zustand gehalten.[33]
Daneben gibt es verschiedene, zumeist experimentelle Methoden, Biofilme zu verhindern bzw. zu bekämpfen. Dabei wird häufig durch Vorbeugung versucht, es gar nicht erst zur Bildung von Biofilmen kommen zu lassen. Beispiele für verschiedene Ansätze sind:
- Eintrag von organischen Nährstoffen minimieren, um den Mikroorganismen die Lebensgrundlage zu entziehen
- Maßnahmen zur Desinfektion und Entkeimung des Wassers, z. B. Chlorung
- mechanische Zerstörung der Biofilme
- In der Biotechnik müssen Biofilme in Rohrleitungen, die reines und hochreines Wasser transportieren, verhindert werden. In der Regel wird dazu Ozon eingespeist.
- Bakteriophagen[34]
- antimikrobielle Peptide (AMPs)
- Störung der Kommunikation (Quorum sensing) der Bakterien im Biofilm zur Verhinderung der Ansiedlung bzw. deren Ablösung
- Oberflächenmodifikation (bakterienabweisende Beschichtungen)
- Hydrophilisierung
- Nanostrukturierung (siehe Lotuseffekt)
- negative Ladung
- Plasmabehandlung, z. B. Auftragen von diamant-ähnlichem Carbon (diamond-like carbon (DLC))
- Vermeidung rauer Oberflächen
- antibiotische Beschichtung, z. B. Minocyclin-Rifampicin
- antiseptische Beschichtung, z. B. Chlorhexidin-Silbersulfadiazin
- Einbringung von Metallen, z. B. Silber, Platin, Bismut
- Bakterien-Beschichtung, z. B. nicht-krankheitserregender (apathogener) Escherichia coli auf Blasenkatheter[36]
- dynamische Oberflächen (häufig mit bionischem Ansatz)
- elektrischer Strom
- „Häutung“ oder „Schälung“
- „Herauswachsen“ von Strukturen
- „Schleimbildung“
- Vibration der Oberfläche[37]
Literatur
- Flemming, H.-C., Wingender, J. (2010): The Biofilm Matrix. Nat. Rev. Microbiol. 8 623-633
- Hans-Curt Flemming, Jost Wingender: Biofilme – die bevorzugte Lebensform der Bakterien: Flocken, Filme und Schlämme. In: Biologie in unserer Zeit. 31(3) (2001), ISSN 0045-205X, S. 169–180.
- Hans-Curt Flemming: Biofilme – das Leben am Rande der Wasserphase. In: Nachrichten aus der Chemie. 4 (2000), S. 442–447.
- Flemming, H.-C., Wingender, J., Kjelleberg, S., Steinberg, P., Rice, S., Szewzyk, U. (2016): Biofilms: an emergent form of microbial life. Nat. Rev. Microbiol. 14, 563-575
- Garth D. Ehrlich, Patrick J. DeMeo, J. William Costerton, Heinz Winkler (Eds.): Culture Negative Orthopedic Biofilm Infections, Series: Springer Series on Biofilms, Vol. 7, 2012, ISBN 978-3-642-29553-9 (Print) 978-3-642-29554-6 (Online)
- R. Walter, K. Büsching, H. Lausch: Wasserentkeimung mit Vollmetallkatalysatoren und Wasserstoffperoxid. In: Wasser, Boden, Luft. 1-2/2005, S. 30.
- John William „Bill“ Costerton: The Biofilm Primer (Springer Series on Biofilms). Springer-Verlag, Berlin/ Heidelberg/ New York 2007, ISBN 978-3-540-68021-5, doi:10.1007/b136878.
- A. Houry, M. Gohar u. a.: Bacterial swimmers that infiltrate and take over the biofilm matrix. In: Proceedings of the National Academy of Sciences of the United States of America. [elektronische Veröffentlichung vor dem Druck] Juli 2012. doi:10.1073/pnas.1200791109, PMID 22773813.
Weblinks
- Michael Lange und Martin Winkelheide: Ein Universum aus Schleim – Wie Bakterien im Biofilm leben, Deutschlandfunk – Wissenschaft im Brennpunkt vom 11. Juni 2006:
- Center for Biofilm Engineering: What is biofilm? (Memento vom 3. Mai 2010 im Internet Archive), Montana State University
- Institut für Umweltverfahrenstechnik der Universität Bremen – Abwasserlexikon: Biofilm
- Stern.de – Wissenschaft und Gesundheit, 27. November 2006: Biofilme: Bakterien-WG im Herzschrittmacher
- Biofilms: The Hypertextbook, Version vom 4. Januar 2010, Montana State University
- Biofilm Centre (Universität Duisburg-Essen): Warum Biofilm-Forschung?
- Gesellschaft Deutscher Chemiker (GDCh): Biofilme in Wässern – nützlich oder schädlich? (Memento vom 5. März 2008 im Internet Archive)
- Pressemitteilung: DFG-Forschergruppe „Physikalische Chemie von Biofilmen“
Einzelnachweise
- ↑ a b c Karl Höll: Wasser. ISBN 978-3-110-22677-5, S. 663–669 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Michel Vert, Yoshiharu Doi, Karl-Heinz Hellwich, Michael Hess, Philip Hodge, Przemyslaw Kubisa, Marguerite Rinaudo, François Schué: Terminology for biorelated polymers and applications (IUPAC Recommendations 2012). In: Pure and Applied Chemistry. 84. Jahrgang, Nr. 2, 2012, S. 377–410, doi:10.1351/PAC-REC-10-12-04 (pac.iupac.org (Memento des vom 19. März 2015 im Internet Archive) [abgerufen am 10. Februar 2016]). Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Andreas Schmidt-Wilckerling: Stoffwechselaktivität von frei suspendierten und immobilisierten Zellen Ammoniak oxidierender Bakterien. Diplomarbeit, Hamburg (1989).
- ↑ a b c Luanne Hall-Stoodley, J. William Costerton u. a.: Bacterial biofilms: from the natural environment to infectious diseases. In: Nature Reviews Microbiology. Bd. 2, Nr. 2, 2004, ISSN 1740-1526, PMID 15040259, doi:10.1038/nrmicro821, S. 95–108 (PDF-Datei; 0,6 MB).
- ↑ Hera Vlamakis, Yunrong Chai, Pascale Beauregard, Richard Losick, Roberto Kolter: Sticking together: building a biofilm the Bacillus subtilis way. In: Nat Rev Micro. 11. Jahrgang, Nr. 3, 2013, S. 157–168, doi:10.1038/nrmicro2960.
- ↑ Yunrong Chai, Thomas Norman, Roberto Kolter, Richard Losick: An epigenetic switch governing daughter cell separation in Bacillus subtilis. In: Genes & Development. 24. Jahrgang, Nr. 8, 2010, S. 754–765, doi:10.1101/gad.1915010 (cshlp.org).
- ↑ Jintao Liu, Arthur Prindle, Jacqueline Humphries, Marcal Gabalda-Sagarra, Munehiro Asally, Dong-yeon D. Lee, San Ly, Jordi Garcia-Ojalvo, Gurol M. Suel: Metabolic co-dependence gives rise to collective oscillations within biofilms. In: Nature. 523. Jahrgang, Nr. 7562, 2015, S. 550–554, doi:10.1038/nature14660.
- ↑ Arthur Prindle, Jintao Liu, Munehiro Asally, San Ly, Jordi Garcia-Ojalvo, Gurol M. Suel: Ion channels enable electrical communication in bacterial communities. In: Nature. 527. Jahrgang, Nr. 7576, 2015, S. 59–63, doi:10.1038/nature15709.
- ↑ James A Shapiro: Thinking about bacterial populations as multicellular organisms. In: Annual Reviews in Microbiology. 51. Jahrgang, Nr. 1, 1998, S. 81–104, doi:10.1146/annurev.micro.52.1.81 (annualreviews.org [PDF]).
- ↑ Carl R. Woese, Nicholas Chia, Nigel Goldenfeld: A collective mechanism for phase variation in biofilms. In: Proceedings of the National Academy of Sciences. 105. Jahrgang, Nr. 38, 2008, S. 14597–14602, doi:10.1073/pnas.0804962105 (pnas.org).
- ↑ Kim Lewis: Riddle of biofilm resistance. In: Antimicrobial agents and chemotherapy. Bd. 45, Nr. 4, 2001, ISSN 0066-4804, PMID 11257008, doi:10.1128/AAC.45.4.999-1007.2001, S. 999–1007 (PDF-Datei; 0,2 MB).
- ↑ Ulrich Szewzyk, Regine Szewzyk: Biofilme − die etwas andere Lebensweise (Memento des vom 7. Mai 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.. In: BIOspektrum. Jg. 9, 2003, ISSN 0947-0867, S. 253–255. (PDF-Datei; 0,3 MB).
- ↑ C. Mark Ott, Rebekah J. Bruce u. a.: Microbial characterization of free floating condensate aboard the Mir space station. In: Microbial ecology. Bd. 47, Nr. 2, 2004, ISSN 1432-184X, PMID 14569419, doi:10.1007/s00248-003-1038-3, S. 133–136, PDF-Datei; 0,9 MB. (Memento vom 15. Mai 2009 im Internet Archive)
- ↑ Joe J. Harrison, Raymond J. Turner u. a.: Biofilms – A new understanding of these microbial communities is driving a revolution that may transform the science of microbiology. In: American scientist. Bd. 93, Nr. 6, 2005, ISSN 0003-0996, doi:10.1511/2005.6.508, S. 508–515. (online-Version) (Memento vom 17. November 2007 im Internet Archive).
- ↑ Christoph A. Fux, J. William Costerton u. a.: Survival strategies of infectious biofilms. In: Trends in microbiology. Bd. 13, Nr. 1, 2005, ISSN 0966-842X, PMID 15639630, doi:10.1016/j.tim.2004.11.010, S. 34–40.
- ↑ Yogita N. Sardessai: Viable but non-culturable bacteria: their impact on public health. In: Current science. Bd. 89, Nr. 10, 2005, ISSN 0011-3891, S. 1650. (PDF-Datei; 0,01 MB) (Memento des vom 16. April 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- ↑ Eliana Drenkard, Frederick M. Ausubel: Pseudomonas biofilm formation and antibiotic resistance are linked to phenotypic variation. In: Nature. Bd. 416, Nr. 6882, 2002, ISSN 1476-4687, PMID 11961556, doi:10.1038/416740a, S. 740–743 (PDF-Datei; 0,3 MB) (Memento des vom 3. September 2006 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ J. William Costerton, Philip S. Stewart u. a.: Bacterial biofilms: a common cause of persistent infections. In: Science. Bd. 284, Nr. 5418, 1999, ISSN 0036-8075, PMID 10334980, S. 1318–1322.
- ↑ Luanne Hall-Stoodley, Fen Ze Hu u. a.: Direct detection of bacterial biofilms on the middle-ear mucosa of children with chronic otitis media. In: The Journal of the American Medical Association. Bd. 296, Nr. 2, 2006, ISSN 0098-7484, PMID 16835426, doi:10.1001/jama.296.2.202, S. 202–211.
- ↑ Joseph M. Patti: Vaccines and immunotherapy for staphylococcal infections. In: The international journal of artificial organs. Bd. 28, Nr. 11, 2005, ISSN 0391-3988, PMID 16353122, S. 1157–1162.
- ↑ Rodney M. Donlan: Biofilms and device-associated infections. In: Emerging Infectious Diseases. Bd. 7, Nr. 2, 2001, ISSN 1080-6040, PMID 11294723, S. 277–281. (PDF-Datei; 0,1 MB).
- ↑ Henk J. Busscher, Gésinda I. Geertsema-Doornbusch u. a.: Adhesion to silicone rubber of yeasts and bacteria isolated from voice prostheses: influence of salivary conditioning films. In: Journal of biomedical materials research. Bd. 34, Nr. 2, 1997, ISSN 0021-9304, PMID 9029300, doi:10.1002/(SICI)1097-4636(199702)34:2%3C201::AID-JBM9%3E3.0.CO;2-U, S. 201–209.
- ↑ Klaus Müller: Alles dem Patienten überlassen?. In: Dental Magazin 5/2007, S. 36–39 ISSN 0176-7291, Archivierte Kopie (Memento des vom 4. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- ↑ D. Keast, T. Swanson, E. Carville, I. Fletcher, G. Schultz, J. Black: Ten Top Tipps. Understanding and managing wound biofilm in Wounds International Journal 2014, 5(2), Seite 20–24
- ↑ a b Christine Murphy, Lianne Atkin, Terry Swanson et al: Defying hard-to-heal wounds with an early antibiofilm intervention strategy: wound hygiene. An international consensus document, Journal of Wound Care, Vol 29, März 2020 Text online bei MAG online library aufgerufen am 19. Juli 2020
- ↑ Kerstin Protz: Moderne Wundversorgung Praxiswissen, Standards und Dokumentation, Elsevier Verlag Urban & Fischer, München 2016, ISBN 978-3-437-27885-3, Seite 27–28
- ↑ a b C. U. Schwermer, G. Lavik, R. M. M. Abed, B. Dunsmore, T. G. Ferdelman, P. Stoodley, A. Gieseke, D. de Beer: Impact of nitrate on the structure and function of bacterial biofilm communities in pipelines used for injection of seawater into oil fields. In: Applied and Environmental Microbiology. 74 (2008), S. 2841–2851. (online).
- ↑ VDI 2047 Blatt 2:2015-01 Rückkühlwerke; Sicherstellung des hygienegerechten Betriebs von Verdunstungskühlanlagen (VDI-Kühlturmregeln) (Open recooler systems; Securing hygienically sound operation of evaporative cooling systems (VDI Cooling Tower Code of Practice)). Beuth Verlag, Berlin. S. 11.
- ↑ VDI 3478 Blatt 2:2008-04 Biologische Abgasreinigung; Biorieselbettreaktoren (Biological waste gas purification; Biological trickle bed-reactors). Beuth Verlag, Berlin. S. 12.
- ↑ Jürgen Koppe, Stefan Winkens: Vollumfängliche Einhaltung der VDI 6022 – Möglich durch Festkörper-Katalysatoren bei der H2O2-Desinfektion von Luftbefeuchtern. In: HLH Lüftung/Klima, Heizung/Sanitär, Gebäudetechnik. Bd. 59, Nr. 2, 2008, ISSN 1436-5103, S. 22–27.
- ↑ Informationszentrum für betrieblichen Umweltschutz (IBU) (Memento vom 16. Januar 2017 im Internet Archive)
- ↑ Simone Schulte: Wirksamkeit von Wasserstoffperoxid gegenüber Biofilmen, Dissertation an der Uni Duisburg-Essen, 2003.
- ↑ Till Elgeti, Sebastian Janning, Jan Koppe, Jürgen Koppe: Lichtinduzierte Katalyse in der Wasserbehandlung. In: WLB. 05/2010. (online) (Seite nicht mehr abrufbar, festgestellt im April 2018. Suche in Webarchiven.) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis..
- ↑ Timothy K. Lu, James J. Collins: Dispersing biofilms with engineered enzymatic bacteriophage. In: Proceedings of the National Academy of Sciences of the USA. Bd. 104, Nr. 27, 2007, ISSN 0027-8424, PMID 17592147, doi:10.1073/pnas.0704624104, S. 11197–11202. (PDF-Datei; 1,7 MB).
- ↑ Jemy A. Gutierrez, Tamara Crowder u. a.: Transition state analogs of 5'-methylthioadenosine nucleosidase disrupt quorum sensing. In: Nature Chemical Biology. Online-Veröffentlichung, 8. März 2009, doi:10.1038/nchembio.153
- ↑ Barbara W. Trautner, Richard A. Hull u. a.: Coating urinary catheters with an avirulent strain of Escherichia coli as a means to establish asymptomatic colonization. In: Infection Control and Hospital Epidemiology. Bd. 28, Nr. 1, 2007, ISSN 0899-823X, PMID 17230395, doi:10.1086/510872, S. 92–94.
- ↑ Zadik Hazan, Jona Zumeris u. a.: Effective prevention of microbial biofilm formation on medical devices by low-energy surface acoustic waves. In: Antimicrobial Agents and Chemotherapy. Bd. 50, Nr. 12, 2006, ISSN 0066-4804, PMID 16940055, doi:10.1128/AAC.00418-06, S. 4144–4152.
(FSE) Georg Fuchs, Hans Günter Schlegel, Thomas Eitinger: Allgemeine Mikrobiologie. 9., vollständig überarbeitete und erweiterte Auflage. Georg Thieme Verlag, Stuttgart 2014, ISBN 978-3-13-444609-8.
Auf dieser Seite verwendete Medien
Autor/Urheber: Asw-hamburg, Lizenz: CC BY-SA 4.0
Oben: Biofilm, der auf einer Fläche (Substratum) bewachsen hat. Unten: Schwebstoff in einem Gewässer.
Autor/Urheber: D. Davis, Lizenz: CC BY 2.5
5 stages of biofilm development. Stage 1, initial attachment; stage 2, irreversible attachment; stage 3, maturation I; stage 4, maturation II; stage 5, dispersion. Each stage of development in the diagram is paired with a photomicrograph of a developing Pseudomonas aeruginosa biofilm. All photomicrographs are shown to same scale
Autor/Urheber: Asw-hamburg, Lizenz: CC BY-SA 4.0
Bifofilm of an nitrifying Bacterium (Nitrosolobus spec.)
Autor/Urheber: Krzysztof A. Zacharski, Lizenz: CC BY 4.0
Scanning electron micrograph of mixed-culture biofilm, demonstrating in detail a spatially heterogeneous arrangement of bacterial cells and extracellular polymeric substances. The stainless steel (type 316) sample surface was incubated under high fluid shear stress and continuous flow conditions in the CDC Biofilm Reactor at 50 °C for 22h with high-heat skimmed milk powder reconstituted and preheated to 72 °C. Cocci and bacilli could be observed, although a direct correlation between bacterial morphological differences and clinical/radiographic findings was not established by means of SEM evaluation.
This electron micrograph depicted large numbers of Staphylococcus aureus bacteria, which were fond on the luminal surface of an indwelling catheter. Of importance is the sticky-looking substance woven between the round cocci bacteria, which was composed of polysaccharides, and is known as “biofilm”. This biofilm has been found to protect the bacteria that secrete the substance from attacks by antimicrobial agents such as antibiotics; Magnified 2363x.
- S. aureus, often referred to simply as "staph," are bacteria commonly carried on the skin, or in the nose of healthy people. Approximately 25% to 30% of the population is colonized, i.e., when bacteria are present, but not causing an infection, in the nose with staph bacteria.
- Sometimes, staph can cause an infection. Staph bacteria are one of the most common causes of skin infections in the United States. Most of these skin infections are minor such as pimples and boils, and can be treated without antibiotics, which are also known as antimicrobials or antibacterials. However, staph bacteria also can cause serious infections such as surgical wound infections, bloodstream infections, and pneumonia.
- Some staph bacteria are resistant to antibiotics. Methicillin-Resistant Staphylococcus aureus, or MRSA, is a type of staph that is resistant to antibiotics called beta-lactams. Beta-lactam antibiotics include methicillin and other more common antibiotics such as oxacillin, penicillin and amoxicillin. While 25% to 30% of the population is colonized with staph, approximately 1% is colonized with MRSA.
Polymicrobic biofilm grown on a stainless steel surface in a laboratory potable water biofilm reactor for 14 days, then stained with 4,6-diamidino-2-phenylindole (DAPI) and examined by epifluorescence microscopy. Bar, 20 µm.
Autor/Urheber: Asw-hamburg, Lizenz: CC BY-SA 4.0
Ai2, a Pheromon of Vibrio harveyi
Autor/Urheber: H. S. Tee, D. Waite, L. Payne, M. Middleditch, S. Wood, K. M. Handley, Lizenz: CC BY 4.0
Community composition of Microcoleus-dominated mats.
Microscopy images of Microcoleus, eukaryotic phototrophs (diatoms and Cosmarium), and biofilm grazers (chironomid larvae and rotifers).
Autor/Urheber: Asw-hamburg, Lizenz: CC BY-SA 4.0
Makromoleküle im Intrazellularraum eines Biofilms










