Alkaliphilie
Alkaliphilie ist die Eigenschaft von Lebewesen, eine alkalische Umgebung (also mit hohem pH-Wert) zu bevorzugen. Lebewesen mit dieser Eigenschaft werden als alkaliphil bezeichnet. Oft wird auch die sprachlich inkorrekte Form Alkalophilie (bzw. alkalophil) verwendet.
Organismen, die an einen mittleren pH-Wert angepasst sind, werden als neutrophil bezeichnet. Acidophile Lebewesen sind an sehr saure Umweltbedingungen mit niedrigem pH-Wert angepasst.
Alkaliphile Mikroorganismen
Alkaliphile Organismen kommen meistens in hoch basischen Biotopen wie z. B. carbonathaltigen Böden und alkalischen Sodaseen vor. Zu den alkaliphilen Mikroorganismen gehören beispielsweise Cyanobacterien der Gattung Spirulina und Arthrospira platensis.[1][2] Extrem alkaliphile Bakterien gehören insbesondere zu den Gattungen Bacillus und Clostridium.
Manche alkaliphile Bakterien sind in der Lage, ihre Umgebung zu verändern, indem sie neutrales Medium alkalisieren oder hochalkalisches Medium ansäuern und damit den pH-Wert für ihr Wachstum optimieren. Ihre extracellulär ausgeschiedenen Enzyme haben ihr Optimum im stark alkalischen Bereich. Solche Enzyme haben z. B. in der Waschmittelindustrie eine wichtige technische Bedeutung.
Alkaliphile Mikroorganismen sind extremophil: Sie gehören zu den Lebewesen, die an einen extremen Lebensraum angepasst sind. Das pH-Optimum des Wachstums liegt bei pH 10. Manche können in stark alkalischen Medien mit einem pH-Wert von 11 wachsen.
Aufrechterhaltung eines neutralen pH-Werts im Zellinneren
Ihre Anpassung an alkalische Lebensräume erfordert die Überwindung grundsätzlicher Probleme. Ein hoher pH-Wert im Inneren der Zellen ist zerstörerisch. Beispielsweise werden DNA und vor allem RNA bei hohen pH-Werten hydrolytisch zersetzt. Zum Schutz benötigen alkaliphile Organismen einen Mechanismus, mit dem sie im Zellinneren den Anstieg des pH-Werts begrenzen, der durch ihre alkalisches Umgebung droht.
Abb. 1 zeigt die Auswirkung der nach rechts zunehmenden Alkalität des Nährmediums auf den pH-Wert im Zellinneren. Im Bereich bis etwa pH 10,5 zeigen die dort blau dargestellten alkaliphilen Bakterien im Inneren kaum höhere pH-Werte als die beiden grün abgebildeten neutrophilen Referenz-Organismen. Bei dem Bakterium Clostridium paradoxum zeigt sich beispielsweise, dass der pH-Wert im Inneren physiologisch zunehmend ungünstig wird, wenn die Alkalinität über diesen Wert ansteigt.
Die Mechanismen zur Anpassung von Clostridium paradoxum an die alkalische Umgebung sind in Abb. 2 dargestellt.
Clostridium paradoxum[5] ist ein thermophiles alkaliphiles anaerobes Bakterium, das ATP unter anderem durch Homoacetatgärung von Glucose gewinnen kann. Unter ATP-Verbrauch kann der Organismus mittels einer ATP-Synthase Na+ durch die Membran befördern. Zudem besitzt das acetogene Bakterium in seiner Zellmembran eine Ferredoxin:NAD-Oxidoreductase (Rnf-Komplex), die als Na+Ionenpumpe fungiert.
Durch beide entsteht ein chemiosmotisches Membranpotenzial ΔP, das sich aus der elektrischen Spannung ΔΨ (außen positiv geladen) und dem ΔNa+-Konzentrationsunterschied zusammensetzt. Zurück strömende Na+-Ionen ermöglichen den Import von Glucose. Dessen Vergärung liefert Essigsäure, die durch die Membran nach außen diffundiert. Im alkalischen Äußeren dissoziiert Essigsäure in das Acetat-Anion und H+. Durch einen Na+/H+-Antiporter gelangt das H+ wieder in die Zelle und wirkt dessen Alkalisierung entgegen.[6][7] So nutzt das Bakterium die bei der Gärung entstandene Säure zur Stabilisierung seines inneren pH-Werts.
Die Zellwand alkaliphiler Bakterien ist speziell mit Teichonsäuren angereichert, deren negative Ladung eine Barriere gegen die OH−-Ionen des Mediums bilden. Der Raum zwischen der aus Peptidoglykan bestehenden Zellwand und der Zellmembran kann so einen deutlich niedrigeren pH-Wert erhalten als das alkalische Medium, in dem das Bakterium lebt. Innerhalb dieses Raums tritt ein pH-Gradient auf. Direkt an der Außenseite der Zellmembran ist der pH-Wert am niedrigsten.
Chemiosmose alkaliphiler Bakterien
Der Energiestoffwechsel nahezu aller Organismen beruht auf dem Betrieb von ATP-Synthasen. Sie ermöglicht eine erheblich höhere ATP-Ausbeute als die Substratkettenphosphorylierung bei Gärungsprozessen, auf die vergleichsweise wenige chemotrophe anaerobe Organismen beschränkt sind.
Die chemiosmotische Energie für die von der ATP-Synthase katalysierten endergonischen ATP-Bildung stellt die überwiegende Mehrheit der Organismen dadurch bereit, dass sie durch H+-Export an ihrer Zellmembran eine elektrische Spannung und einen energiereichen Protonengradienten aufbauen. Der Rückstrom der H+Ionen durch die ATP-Synthase stellt diesem Enzym die Energie zur Verfügung.
Alkaliphile Organismen können kein Membranpotenzial dadurch aufbauen, dass sie H+Ionen in ihr Nährmedium abgeben. Diese Kationen würden sofort mit den OH−-Anionen zu Wasser reagieren, die Energie würde als Wärme frei und wäre für die Organismen nicht mehr nutzbar. Lange Zeit wurde daher vermutet, dass alkaliphile Organismen eine Na+-angetriebene ATP-Synthase zur Energiegewinnung nutzen müssen. Diese Vermutung wurde dadurch bestärkt, dass in Clostridien wie Clostridium paradoxum Na+-ATP-Synthasen gefunden wurden.[8] Solche Na+ getriebenen ATP-Synthasen sind jedoch nicht typisch für alkaliphile Organismen, sondern für acetogene Bakterien, zu denen auch Clostridium paradoxum gehört und für methanogene Archaeen. Diese beiden Gruppen sind keineswegs auf alkalische Biotope beschränkt.
Bei einigen alkaliphilen Organismen lieferten biochemische Analysen den Nachweis von H+ getriebenen ATP-Synthasen. Bei dem Vergleich der Genome einer ganzen Reihe unterschiedlicher alkaliphiler Lebewesen mit denen ihrer nahen neutrophilen Verwandten fanden sich regelmäßig Gene für ATP-Synthasen, die keine wesentliche Unterschiede aufwiesen. Einen entscheidenden Hinweis für die materielle Grundlage der Alkaliphilie lieferten Mutanten mit verminderter Wachstumsfähigkeit bei hohen pH-Werten. Sie wiesen Defizite beim Aufbau ihrer Zellwand und dem Raum zwischen Zellwand und Zellmembran auf.
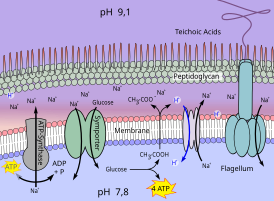
Die molekulare Grundlage der Alkaliphilie des alkaliphilen Bakteriums Bacillus pseudofirmus ist schematisch in Abb. 3 dargestellt. B. pseudofirmus wächst aerob auf organischen Medien und hält, wie in Abb. 1 dargestellt, bis zu einem pH der Umgebung von fast 11 sein Cytosol im neutralen Bereich.
Die Atmungskette (Respiration) dieses Bakteriums transportiert H+ durch die Zellmembran. Hier sind verschiedene Carotinoide und Cytochrome angelagert. Die Cytochrome spielen dabei auch die Rolle eines Protonentransporters. Sie werden von Bacillus pseudofirmus verstärkt gebildet bei hohem pH-Wert und niedrigen Sauerstoffkonzentrationen.[9] So fließt durch die an der Membran-Außenseite angelagerten Moleküle ein in gewissem Sinne kanalisierter Strom von H+-Ionen zur ATP-Synthase.
Auch ein Mrp-Antiporter wird mit Protonen beliefert. Er tauscht H+ gegen Na+ aus. Dieser Austausch bringt dem Organismus wesentliche Vorteile. Zum einen wird durch den Reimport der H+-Kationen der Alkalisierung der Zellen entgegengewirkt. Die nach außen gepumpten Na+-Ionen erhalten die elektrische Spannung an der Zellmembran aufrecht, ohne Gefahr zu laufen, durch OH− neutralisiert zu werden. Einströmendes Na+ nutzt das Bakterium energetisch zur Aufnahme von Nährstoffen durch einen Symporter und zum Betrieb der Geißel (Flagellum). Ein Na+-Membran-Kanal (NaBP) kann bei Natriummangel in der Zelle geöffnet werden und wird als Überspannungsschutz spannungsabhängig geöffnet oder geschlossen.[10][11]
Alkaliphile Cyanobakterien verfügen über einen grundsätzlich anderen Mechanismus, mit dem sie ein H+-Membranpotential nutzen können. Spirulina platensis hält bei einem äußeren pH-Wert von 10 im Cytoplasma einen pH-Wert von 8,2. ATP wird an einer Thylakoid-Membran gebildet, die sich ohne Kontakt zur Außenwelt mitten in der Zelle befindet. Das Medium in diesem Vesikel ist mit pH 6,4 sogar leicht sauer. Nach außen wird wie bei Bacillus pseudofirmus ein Na+-Potential aufgebaut und mit einem H+-/Na+-Antiporter der Ansäuerung des Zellinneren entgegengewirkt.[12]
Einzelnachweise
- ↑ D. B. Hicks, J. Liu, M. Fujisawa, T. A. Krulwich: F1F0-ATP synthases of alkaliphilic bacteria: lessons from their adaptations. In: Biochimica et Biophysica Acta. Band 1797, Nummer 8, August 2010, S. 1362–1377, doi:10.1016/j.bbabio.2010.02.028, PMID 20193659, PMC 2890045 (freier Volltext) (Review).
- ↑ D. Pogoryelov, J. Yu, T. Meier, J. Vonck, P. Dimroth, D. J. Muller: The c15 ring of the Spirulina platensis F-ATP synthase: F1/F0 symmetry mismatch is not obligatory. In: EMBO reports. Band 6, Nummer 11, November 2005, S. 1040–1044, doi:10.1038/sj.embor.7400517, PMID 16170308, PMC 1371026 (freier Volltext).
- ↑ G. M. Cook: The Intracellular pH of Clostridium paradoxum, an Anaerobic, Alkaliphilic, and Thermophilic Bacterium. In: Applied and Environmental Microbiology. Vol. 62, No. 12, 1996, S. 4576–4579.
- ↑ Terry Ann Krulwich: Adaptive Mechanisms of Extreme Alkaliphiles. In: Koki Horikoshi: Extremophiles Handbook. New York 2011, ISBN 978-4-431-53897-4, S. 123.
- ↑ Youhong Li, Linda Mandelco, Juergen Wiegel: Isolation and Characterization of a Moderately Thermophilic Anaerobic Alkaliphile, Clostridium paradoxum sp. nov. (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. In: Int J Syst Evol Microbiol. 43, July 1993, S. 450–460. doi:10.1099/00207713-43-3-450
- ↑ Scott A. Ferguson u. a.: Biochemical and Molecular Characterization of a Na+-Translocating F1Fo-ATPase from the Thermoalkaliphilic Bacterium Clostridium paradoxum. In: J. Bac. 188, 14, 2006.
- ↑ Gregory M. Cook u. a.: The Intracellular pH of Clostridium paradoxum, an Anaerobic, Alkaliphilic, and Thermophilic Bacterium. In: Appl. Environ. Microbiol. December 1996 vol. 62 no. 12, S. 4576–4579.
- ↑ Thomas Meier, Scott A Ferguson, Gregory M Cook, Peter Dimroth, Janet Vonck: Structural Investigations of the Membrane-Embedded Rotor Ring of the F-ATPase from Clostridium paradoxum. In: Journal of Bacteriology. 188, Nr. 22, 2006, S. 7759–7764. doi:10.1128/JB.00934-06. PMC 1636304 (freier Volltext).
- ↑ T. Matsuno, I. Yumoto: Bioenergetics and the Role of Soluble Cytochromes for Alkaline Adaptation in Gram-Negative Alkaliphilic. In: BioMed Research International. 2015, S. 1, doi:10.1155/2015/847945.
- ↑ Laura Preiss u. a.: Alkaliphilic bacteria with impact on industrial applications, concepts of early life forms, and bioenergetics of ATP synthesis. In: Front. Bioeng. Biotechnol. 3. Juni 2015. doi:10.3389/fbioe.2015.00075
- ↑ Koki Horikoshi (Hrsg.): Extremophiles Handbook. New York 2011, ISBN 978-4-431-53897-4.
- ↑ Terry Ann Krulwich: Adaptive Mechanisms of Extreme Alkaliphiles. In: Koki Horikoshi: Extremophiles Handbook. New York 2011, ISBN 978-4-431-53897-4, S. 121–122.
Auf dieser Seite verwendete Medien
Autor/Urheber: Asw-hamburg, Lizenz: CC BY-SA 4.0
Nutrition and pH balance of an thermoalkaliphilic anaerobic bacterium [1]
Autor/Urheber: Asw-hamburg, Lizenz: CC BY-SA 4.0
Diagram of intra- and extracellular pH of alkaliphilic bacteria
Autor/Urheber: Asw-hamburg, Lizenz: CC BY-SA 4.0
Chemiosmosis of Alkaliphilic Bacteria
Autor/Urheber: Bob Blaylock, Lizenz: CC BY-SA 3.0
Where I work, when the weather is really hot, they mix up a cooler of sugar-free Sqwincher for us. The last time, when the weather cooled off, and the last batch of Sqwincher had been neglected for about two weeks, I took a sample to see if anything was growing therein. On direct observation, I was very hard-pressed to find anything that I thought might be alive. I found one object that I thought might be a bacillus. I also put some of this sample in a Petri dish, and on examining that dish, a few days later, I found a considerable growth of bacteria that looked just like the one possible bacillus that I observed directly. This image is of bacteria taken from the Petri dish culture, and Gram-stained.
100× objective, 15× eyepiece; the numbered ticks are 11 µM apart. Gram-stained